Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vi la KL kiem nen PU la : RCl ---> R + 1/2 Cl2 , ncl2 =0.08 mol => n kl = 2*0.08= 0.16mol
M(kimloai) = 6.24/ 0.16 = 39 => kimloai la Kali Chon C

Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
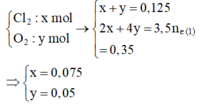
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 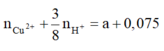
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h
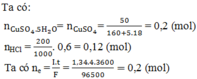



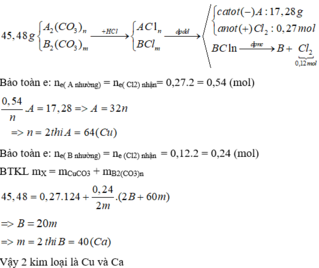
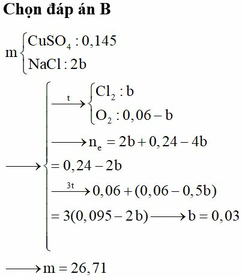


Đáp án A
Thứ tự điện phân tại catot và anot là:
Tại catot: Cu2+ + 2e → Cu
0,1 0,2 0,1
⟹ Cu2+ chưa bị điện phân hết.
⟹ mkim loại ở catot = 0,1.64 = 6,4 (gam)
Tại anot: 2Cl– → Cl2 + 2e
0,12 0,06 0,12
⟹ ne (do Cl– nhường) = 0,12 < 0,2 mol
⟹ tại anot Cl– đã bị điện phân hết và đến nước bị điện phân.
Ta có: ne (do H2O nhường) = 0,2 – 0,12 = 0,08 (mol)
2H2O → O2 + 4H + 4e
0,02 ⟵ 0,08
Vkhí thoát ra ở anot = (0,06 + 0,02).22,4 = 1,792 (lít).