Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
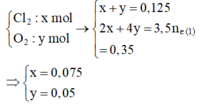
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 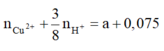
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).

Đáp án B
Trong mỗi phần chứa nCu(NO3)2 = a và nHCl = b
Cu(NO3)2 +2HCl → Cu + Cl2 + 2HNO3
0,14 ←0,28 ←0,14 →0,28
Dung dịch sau điện phân chứa Cu(NO3)2 dư ( a – 0,14) ; HCl dư (b – 0,28) và HNO3 ( 0,28)
nNaOH = 2 ( a – 0,14 ) + ( b – 0,28) + 0,28 = 0,44 (1)
nCu(OH)2 ↓= a – 0,14 = 0,02 (mol) (2)
Từ (1) và (2) => a = 0,16 và b = 0,4
Phần 2:
nHCl = 0,4 mol => nNO = 0,1 => VNO = 2,24 (lít)
Bảo toàn electron:
2nFe pư = 2nCu2+ + 3nNO => nFe pư = 0,31 (mol)
=> m – 0,31.56 + 0,16.64 = 0,7m
=> m = 23,73 (g)
Vậy m = 23,73 g và V = 2,24 lít

Trong mỗi phần chứa nCu(NO3)2 = a và nHCl = b
Cu(NO3)2 +2HCl → Cu + Cl2 + 2HNO3
0,14 ←0,28 ←0,14 →0,28
Dung dịch sau điện phân chứa Cu(NO3)2 dư ( a – 0,14) ; HCl dư (b – 0,28) và HNO3 ( 0,28)
nNaOH = 2 ( a – 0,14 ) + ( b – 0,28) + 0,28 = 0,44 (1)
nCu(OH)2 ↓= a – 0,14 = 0,02 (mol) (2)
Từ (1) và (2) => a = 0,16 và b = 0,4
Phần 2:
nHCl = 0,4 mol => nNO = 0,1 => VNO = 2,24 (lít)
Bảo toàn electron:
2nFe pư = 2nCu2+ + 3nNO => nFe pư = 0,31 (mol)
=> m – 0,31.56 + 0,16.64 = 0,7m
=> m = 23,73 (g)
Vậy m = 23,73 g và V = 2,24 lít
Đáp án B

Chọn C.
Dung dịch Y chứa H+ với n H + = 2 n H 2 = 0 , 12 mol ⇒ H + ban đầu: 0 , 12 + 2 n H 2 ⇒ n O 2 = 0 , 03 + 0 , 5 n H 2
Khối lượng dung dịch giảm:
m Cu + m khí = 300 - 283 , 32 = 16 , 68 ⇒ 64 n Cu + 71 n Cl 2 + 18 n H 2 = 15 , 72 (1)
→ BT : e 2 n Cu = 0 , 12 + 2 n Cl 2 (2) và
160 n Cu + 117 n Cl 2 = 31 , 76 (3)
Từ (1), (2), (3) suy ra:
n Cu = 0 , 14 mol ; n Cl 2 = 0 , 08 mol ; n H 2 = 0 , 06 mol ⇒ n O 2 = 0 , 06 mol
Vậy V = 3,136 lít.

Đáp án A
I = 2,68 A; t = 6h ; nKhí = 4,48/22,4 = 0,2 (mol)
![]()
Tại catot xảy ra quá trình oxi hóa Cu2+ Tại anot xảy ra quá trình oxi hóa Cl-, H2O
Cu2+ +2e → Cu 2Cl- → Cl2 + 2e
a → 0,5a → 2a (mol)
2H2O → O2 + 4H+ + 4e
b → 0,5b → 2b → 2b (mol)
Vì dung dịch sau phản ứng tác dụng được với Fe và rắn thu được gồm 2 kim loại => Cu2+ còn dư sau quá trình điện phân. Và có khí NO thoát ra => tại anot H2O bị điện phân để sinh ra H+
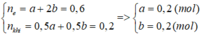
=> nH+ = 2b = 0,4 (mol)
Vì Fe dư sau phản ứng nên Fe chỉ lên số oxi hóa +2; gọi số mol Cu2+ dư là x (mol)
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,15 ← 0,4 (mol)
Fe + Cu2+ → Fe2+ + Cu↓
x ← x → x (mol)
Khối lượng kim loại giảm: ∆ giảm = mFe phản ứng – mCu sinh ra
=> (20 – 12,4) = 0,15 + x).56 – 64x
=> x = 0,1 (mol)
=> nCu2+ bđ = nCu2+ đp + nCu2+ dư = 0,6/2 + 0,1 = 0,4 (mol)
=> m = mCu(NO3)2 + mNaCl = 0,4. 188 + 0,2. 58,5 = 86,9 (g)