Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài, sắt còn dư sau khi phản ứng với lưu huỳnh
PTHH: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
Ta có: \(n_{hhkhí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_{Fe\left(3\right)}+n_{FeS}=\Sigma n_{Fe}\)
\(\Rightarrow m_{Fe}=0,12\cdot56=6,72\left(g\right)\)

Đáp án A
Coi hỗn hợp X gồm a mol Fe và b mol O.
Quá trình nhường electron:
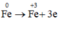
Các quá trình nhận e:
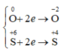
có
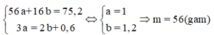

Đáp án A
Coi hỗn hợp X gồm a mol Fe và b mol O.
Quá trình nhường electron:


Đáp án C
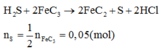
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu



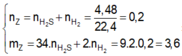
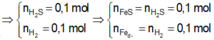
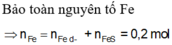
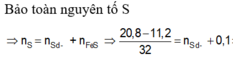
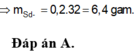

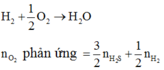
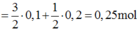
nS ban đầu = 6,4/32 = 0,2 mol
Chất rắn không tan đó là S dư
nS phản ứng = 6,4-3,2 = 3,2 gam
⇒ nS = 3,2/32 = 0,1 mol
PTHH :
Fe + S --to--> FeS
0,1_0,1_______ 0,1
FeS + 2HCl → FeCl2 + H2S
0,1__________________0,1
⇒ nH2S = 0,1 mol
nhh khí = 6,72/22,4 =0,3 mol
⇒ nH2 = 0,3 - 0,1 = 0,2 mol
Fe + 2HCl → FeCl2 + H2
0,2 ___________________0,2
nFe = nH2 = 0,2 mol
⇒ nFe ban đầu = 0,1+0,2 = 0,3 mol ⇒ m = 0,3.56 = 16,8 gam
Vì nFe > nS nên hiệu suất tính theo S
H= 0,1/0,2.100% = 50%