Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 4:
-Gọi thể tích H2SO4 0,2M là a lít\(\rightarrow\)\(n_{H_2SO_4}=0,2amol\)
-Gọi thể tích H2SO4 0,5M là b lít\(\rightarrow\)\(n_{H_2SO_4}=0,5bmol\)
-Thể tích dung dịch=(a+b)lít
-Số mol H2SO4 thu được=0,2a+0,5b
\(C_{M_{H_2SO_4}}=\dfrac{0,2a+0,5b}{a+b}=0,3\)
\(\rightarrow\)0,2a+0,5b=0,3a+0,3b\(\rightarrow\)0,1a=0,2b\(\rightarrow\)\(\dfrac{a}{b}=\dfrac{0,2}{0,1}=\dfrac{2}{1}\)
Bài 5:
\(m_{dd_{BaCl_2}}=400.1,003=401,2gam\)
\(n_{BaCl_2}=\dfrac{401,2.5,2}{208.100}=0,1003mol\approx0,1mol\)
\(m_{dd_{H_2SO_4}}=100.1,4=140gam\)
\(n_{H_2SO_4}=\dfrac{140.20}{98.100}\approx0,3mol\)
BaCl2+H2SO4\(\rightarrow\)BaSO4\(\downarrow\)+2HCl
-Tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{1}\rightarrow H_2SO_4dư\)
\(n_{BaSO_4}=n_{H_2SO_4\left(pu\right)}=n_{BaCl_2}=0,1mol\)
\(n_{H_2SO_4\left(dư\right)}=0,3-0,1=0,2mol\)\(\rightarrow m_{H_2SO_4}=0,2.98=19,6gam\)
\(m_{BaSO_4}=0,1.233=23,3gam\)
\(n_{HCl}=2n_{BaCl_2}=0,2mol\rightarrow m_{HCl}=0,2.36,5=7,3gam\)
\(m_{dd}=401,2+140-23,3=517,9gam\)
C%HCl=\(\dfrac{7,3}{517,9}.100\approx1,4\%\)
C%H2SO4=\(\dfrac{19,6}{517,9}.100\approx3,8\%\)

Al + XCl3 => AlCl3 + X
khối lượng chất tan trong ddY giảm 4,04g so vs dd XCl3
=> mXCl3 - mAlCl3 = 4,04 (g)
<=> mX - mAl = 4,04
=> mX = 4,04 + 3,78 =7,82(g)
thep PTHH nXCl3 = nAl = 3,78/ 27 = 0,14 (g)
=> nX = nXCl3 = 0,14 => MX = 7,82 : 0,14 = 56 => FeCl3

MgO + H2SO4 =>MgSO4 + H2O
0,25 mol =>0,25 mol=>0,25 mol
mH2SO4=0,25.98=24,5g=>mddH2SO4=24,5/25%=98g
mdd MgSO4=0,25.40+98=108g
mMgSO4=0,25.120=30g=>mH2O trong dd=108-30=78g
Gọi nMgSO4.7H2O tách ra= a mol
=>mMgSO4 kết tinh=120a (g)
và mH2O kết tinh=7.18.a=126a(g)
mH2O trong dd sau=78-126a(g)
mMgSO4 trong dd sau=30-120a(g)
Ở 10°C S=28,2g
=>cứ 100g H2O htan đc 28,2g MgSO4 tạo thành 128,2g dd MgSO4 bão hòa
=>78-126a(g)H2O hòa tan 30-120a (g)MgSO4
=>100(30-120a)=28,2(78-126a)=>a=0,09476 mol
=>mMgSO4.7H2O tách ra=0,09476246.=23,31g


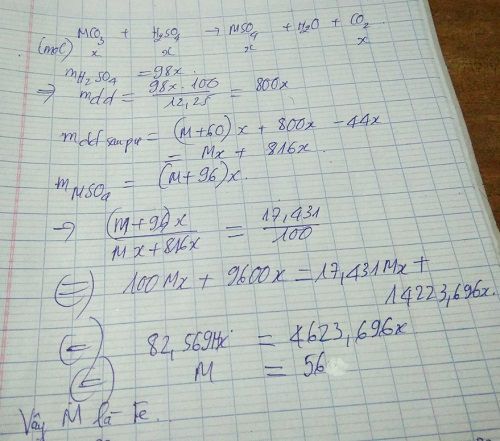
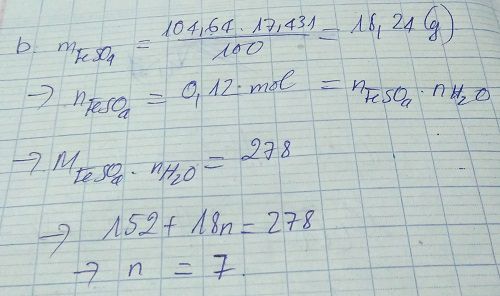


a, - Gọi khối lượng dd H2SO4 vừa đủ là x ( g, x > 0 )
=> \(m_{H_2SO_4}=\frac{C\%.m_{dd}}{100\%}=\frac{12,25\%.x}{100\%}=0,1225x\left(g\right)\)
=> \(m_{H_2O}=m_{dd}-m_{H_2SO_4}=x-0,1225x=0,8775x\left(g\right)\)
=> \(n_{H_2SO_4}=\frac{m}{M}=0,00125x\left(mol\right)\)
PTHH : \(MCO_3+H_2SO_4\rightarrow MSO_4+H_2O+CO_2\)
.............0,00125x..0,00125x......0,00125x............0,00125x.......
=> Sau phản ứng thu được dung dịch MSO4 .
Ta có : \(m_{dd}=m_{MCO_3}+m_{ddH_2SO_4}-m_{CO_2}\)
\(=0,00125x\left(M_M+60\right)+x-0,00125x.44\)
\(=0,00125M_Mx+1,02x=0,00125x\left(M_M+816\right)\)
Ta có : \(m_{MSO_4}=n.M=0,00125x.\left(M_M+96\right)\)
Ta có : \(C\%_{MSO_4}=\frac{0,00125x\left(M_M+96\right)}{0,00125x\left(M_M+816\right)}.100\%=17,431\%\)
=> \(\frac{M_M+96}{M_M+816}=0,17431\)
=> \(M_M\approx56\left(đvc\right)\)
Vậy công thức hóa học là \(FeCO_3\)
b, PTHH : \(FeCO_3+H_2SO_4\rightarrow FeSO_4+H_2O+CO_2\)
=> Sau phản ứng thu được dung dịch muối tạo thành là FeSO4 .
PTHH : \(FeSO_4+nH_2O\rightarrow FeSO_4.nH_2O\)
\(n_{tinhthể}=\frac{m}{M}=\frac{33,36}{152+18n}\left(mol\right)\)
=> \(n_{FeSO_4}=\frac{33,36}{152+18n}\left(mol\right)\)
=> \(m_{FeSO_4}=n.M=\frac{5070,72}{152+18n}\left(g\right)\)
Ta lại có : \(m_{FeSO_4}=\frac{C\%m_{dd}}{100\%}=18,24\left(g\right)\)
=> \(\frac{5070,72}{152+18n}=18,24\)
=> \(n=7\left(TM\right)\)
Vậy công thức của tinh thể là \(FeSO_4.7H_2O\) .
Bài này giả sử số mol MCO3 là 1 mol ra ngay ấy mà :v