Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,03<------------0,03<----0,015
=> \(\%m_{Na}=\dfrac{0,03.23}{1,31}.100\%=52,67\%\)
=> \(\%m_{Na_2O}=100\%-52,67\%=47,33\%\)
b)
\(n_{Na_2O}=\dfrac{1,31.47,33\%}{62}=0,01\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
0,01----------->0,02
=> nNaOH = 0,03 + 0,02 = 0,05 (mol)
mdd sau pư = 1,31 + 18,72 - 0,015.2 = 20 (g)
=> \(C\%_{dd.NaOH}=\dfrac{0,05.40}{20}.100\%=10\%\)
\(V_{dd.NaOH}=\dfrac{20}{1,2}=\dfrac{50}{3}\left(ml\right)=\dfrac{1}{60}\left(l\right)\)
\(C_{M\left(dd.NaOH\right)}=\dfrac{0,05}{\dfrac{1}{60}}=3M\)

a,Fe + 2HCl → FeCl + H2 (1)
FeO + 2HCl → FeCl + H2O (2)
nH2 = 3,36/ 22,4 = 0,15 ( mol)
Theo (1) nH2 = nFe = 0,15 ( mol)
mFe = 0,15 x 56 = 8.4 (g)
m FeO = 12 - 8,4 = 3,6 (g)
a, \(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl->FeCl_2+H_2\left(1\right)\)
\(FeO+2HCl->FeCl_2+H_2O\left(2\right)\)
theo (1) \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{FeO}=12-8,4=3,6\left(g\right)\)

ta thấy : nFe =nH2 = 0,15
=> mFe =0,15 x 56 = 8,4g
%Fe=8,4/12 x 100 = 70%
=>%FeO = 100 - 70 = 30%
b) BTKLra mdd tìm mct of HCl
c) tìm mdd sau pứ -mH2 nha bạn

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

\(a) n_{Fe_2O_3}= \dfrac{8}{160} = 0,05(mol)\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ n_{FeCl_3} = 2n_{Fe_2O_3} = 0,1(mol)\\ m_{FeCl_3} = 0,1.162,5 = 16,25(gam)\\ b) n_{HCl} = 6n_{Fe_2O_3} = 0,05.6 = 0,3(mol)\\ V_{dd\ HCl} = \dfrac{0,3}{0,5} = 0,6(lít)\\ c) V_{dd\ sau\ pư} = V_{dd\ HCl} =0,6(lít)\\ C_{M_{FeCl_3}} = \dfrac{0,1}{0,6} = 0,167M\)
PTHH:\(Fe_2O_3+HCl\rightarrow FeCl_3+3H_2O\)
\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
a, Bảo toàn nguyên tố Fe:
\(n_{FeCl_3}=n_{Fe}=2n_{Fe_2O_3}=2.0,05=0,1\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=162,5.0,1=16,25\left(g\right)\)
b, Bảo toàn nguyên tố Cl:
\(n_{Hcl}=n_{Cl}=3n_{FeCl_3}=3.0,1=0,3\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{n_{HCL}}{C_M}=\dfrac{0,3}{0,5}=0,6\left(l\right)\)
c,\(C_{M_{FeCl_3}}=\dfrac{n_{FeCl_3}}{V_{ddFeCl_3}}=\dfrac{0,1}{0,6}=0,17M\)

a) Y là Cu
$m_{Cu} = 8(gam)$
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có : $27a + 56b + 8 = 13,45(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,025$
$\%m_{Cu} = \dfrac{8}{13,45}.100\% = 59,47\%$
$\%m_{Al} = \dfrac{0,15.27}{13,45}.100\% = 30,11\%$
$\%m_{Fe} = 10,42\%$
b)
$n_{H_2SO_4} = n_{H_2} = 0,25(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,25}{0,5} = 0,5(lít)$

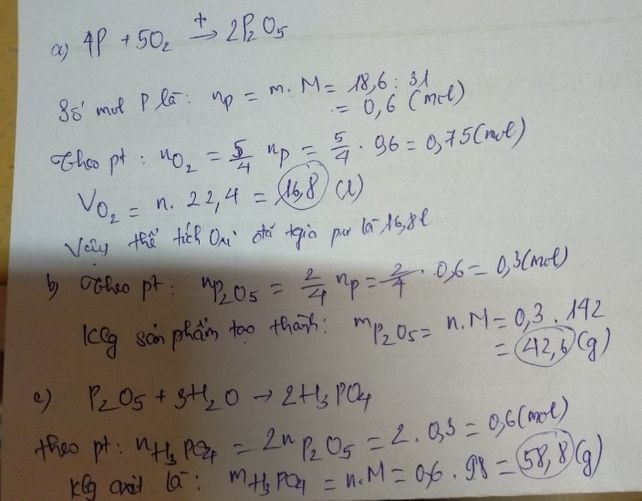
 Bạn tham khảo cách làm nhé! cho mik 1 like nha
Bạn tham khảo cách làm nhé! cho mik 1 like nha
thế còn nồng độ phần trăm đâu