Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số k đẹp lắm nên đã làm tròn rồi nha :)
\(BTKL:m_A=13,86-10,76=3,1\left(g\right)\)
Đặt \(n_{Cl_2}=x\left(mol\right);n_{Br_2}=y\left(mol\right)\)
Theo đề ta có hệ \(\left\{{}\begin{matrix}\frac{x}{y}=\frac{3}{2}\\71x+160y=10,76\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,06\\y=0,04\end{matrix}\right.\)
Đặt \(n_{Mg}=a\left(mol\right);n_{Fe}=b\left(mol\right)\)
\(BTe:2a+3b=0,06.2+0,04.2=0,2\)
Theo đề ta có hệ \(\left\{{}\begin{matrix}24a+56b=3,1\\2a+3b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,0475\\b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}\%m_{Mg}=\frac{0,0475.24}{3,1}.100\%=36,8\%\\\%m_{Fe}=100-36,8=63,2\%\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{O2}:a\left(mol\right)\\n_{Cl2}:5a\left(mol\right)\end{matrix}\right.\)
\(m_{hh\left(khi\right)}=3,87\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O2}=0,01\left(mol\right)\\n_{Cl2}=0,05\left(mol\right)\end{matrix}\right.\)
Nên Fe dư
Đặt \(\left\{{}\begin{matrix}n_{Mg}:x\left(mol\right)\\n_{Fe}:y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}24x+56y=3,2\\2x+2y=0,16\left(BTe\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=3,36\left(g\right)\Rightarrow\%m_{Fe}=77,78\%\)

\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a_______________________a
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b________________________a
\(\Rightarrow a+b=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
a______1,5a_________
\(Mg+Cl_2\rightarrow MgCl_2\)
b_______b________
\(\Rightarrow1,5a+b=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,2\\1,5a+b=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=\frac{0,1.24}{0,1.56+0,1.24}.100\%=30\%\)

Câu 1 :
Oxit có dạng FexOy
\(Fe_xO_y+2yHCl\rightarrow zFeCl_{\frac{2y}{x}}+yH_2O\)
Ta có: \(n_{HCl}=0,16\left(mol\right)\rightarrow n_{H2O}=\frac{1}{2}n_{HCl}=0,08\left(mol\right)=\) nO trong oxit
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\)
\(\rightarrow\) nO bị khử=nO trong oxit=0,08 mol
\(\rightarrow m=4,74-0,08.16=3,36\left(g\right)\)
Bài 2 :
Vì HNO3 loãng dư nên Fe lên hết Fe hóa trị III.
Dung dịch A thu được chứa Fe(NO3)3 và HNO3 dư
Bảo toàn Fe: n Fe(NO3)3 \(n_{Fe}+2n_{Fe2O3}=0,2+0,1.2=0,4\left(mol\right)\)
\(Fe\left(NO_3\right)_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaNO_3\)
\(2Fe\left(OH\right)_3\underrightarrow{^{to}}Fe_3O_3+3H_2O\)
\(\rightarrow n_{Fe}=n_{Fe\left(OH\right)3}=0,4\left(mol\right)\)
\(n_{Fe2O3}=\frac{1}{2}n_{Fe\left(OH\right)3}=0,2\left(mol\right)\)
\(\rightarrow m_{Fe2O3}=m=0,2.\left(56.2+16.3\right)=32\left(g\right)\)
Bài 3 :
\(m_{Cu}=0,2m;m_{Fe}=0,3m\)
Vì sau khi phản ứng với HNO3 còn dư 0,75 m gam rắn \(\rightarrow\) Fe dư
\(\rightarrow\) muối chỉ lên Fe hóa trị II (Fe(NO3)2
Ta có: \(n_{NO}+n_{NO2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{HNO3_{pu}}=\frac{44,1}{63}=0,7\left(mol\right)\)
Bảo toàn N: nHNO3 phản ứng=2nFe(NO3)2 +nNO +nNO2
\(\rightarrow0,1=2n_{Fe\left(NO3\right)2}+0,25\)
\(\rightarrow n_{Fe\left(NO3\right)2}=0,225\left(mol\right)=n_{Fe_{pu}}\)
\(\rightarrow m_{Fe_{pu}}=0,25m=0,225.56=12,6\left(g\right)\rightarrow m=50,4\left(g\right)\)

+) Khối lượng mỗi phần là 10 gam
+) Phần 1 tác dụng với HCl dư thì Fe bị oxi hóa lên Fe2+ (các chất còn lại không cần quan tâm) sinh ra 0,008 mol H2
+) Phần 2 tác dụng với x mol Cl2 thì Fe bị oxi hóa lên Fe3+ (các chất còn lại cũng không cần quan tâm)
Bảo toàn khối lượng, ta có: \(m_A+m_{Cl_2}=10,355\)
\(\Rightarrow m_{Cl_2}=10,355-10=0,355\left(g\right)\Rightarrow n_{Cl_2}=\frac{0,355}{71}=0,005\left(mol\right)\)
+) Vì 2 phần chia ra bằng nhau nên số mol Fe trong mỗi phần là bằng nhau
Ta có: \(n_{Fe}=3n_{Fe^{3+}}-2n_{Fe^{2+}}=2\left(n_{Cl_2}-n_{H_2}\right)=0,002\left(mol\right)\)
+) Vậy số mol Fe trong hỗn hợp A là
\(n_{Fe\left(hhA\right)}=2n_{Fe}=0,004\left(mol\right)\)
\(\Rightarrow m_{Fe\left(hhA\right)}=56\cdot0,004=0,224\left(gam\right)\)

1/ 4Al + 3O2 => 2Al2O3
2Cu + O2 => 2CuO
nO2 = V/22.4 = 4.48/22.4 = 0.2 (mol)
Gọi x,y (mol) lần lượt là số mol của Al và Cu
Theo đề bài và phương trình trên ta có:
27x + 64y = 11.8
3/4x + 1/2y = 0.2
Dùng máy tính giải hệ phương trình (hoặc có thể giải tay) ta được:
x = 0.2; y = 0.1
mAl = n.M = 0.2 x 27 = 5.4 (g)
mCu = n.M = 0.1 x 64 = 6.4 (g)
%Al = 5.4 x 100/11.8
%Cu = 6.4 x 100/11.8
2/ 2Mg + O2 => 2MgO (đk : to)
Mg + Cl2 => MgCl2 (đk : to)
V khí = 6.72 (l) =====> n khí = V/22.4 = 0.3 (mol)
nMg = m/M = 9.6/24 = 0.4 (mol)
Gọi x,y (mol) lần lượt là số mol của O2 và Cl2.
Theo đề bài và phương trình ta có:
x + y = 0.3; 2x + y = 0.4
Giải hệ phương trình ta được:
x = 0.1, y = 0.2
%O2 = 0.1 x 100/0.3
%Cl2 = 0.2 x 100/0.3
nO2 = 1/2 nCl2, O2 = 32, Cl2 = 71
==> M = 58
==> dM/H2 = 58/2 = 29

bài 1
Gọi số mol Cl2 và O2 lần lượt là x , y
=> x + y = 0,3 mol (1)
Ta có:
Bảo toàn e: ∑ne cho = ∑ne nhận
=> 2x+4y = 0,8 (2)
Từ (1) và (2) => x = 0,2 và y = 0,1
=> %mO2 = 0,1.32 : (0,1.32 + 0,2.71).100 = 18,4%
bài 2
Có:
Áp dụng định luật bảo toàn khối lượng ta có:
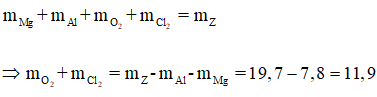
Gọi
Có:
Gọi
Có
Vậy