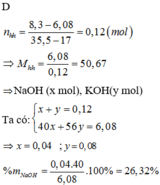Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{H_2}=0,15\left(mol\right)\)
Gọi CTTB của hai kim loại là \(\overline{R}\)
PTHH : \(2\overline{R}+H_2SO_4-->\overline{R}_2SO_4+H_2\uparrow\) (1)
Theo pthh : \(n_{\overline{R}}=2n_{H_2}=0,3\left(mol\right)\)
=> \(M_{\overline{R}}=\frac{10,1}{0,3}\approx33,67\) (g/mol)
Mà hai kim loại thuộc hai chu kì liên tiếp => \(\hept{\begin{cases}Natri:23\left(Na\right)\\Kali:39\left(K\right)\end{cases}}\)
b) \(tổng.n_{H_2SO_4}=\frac{100\cdot19,6}{100\cdot98}=0,2\left(mol\right)\)
Theo pthh : \(n_{H_2SO_4\left(pứ\right)}=n_{H_2}=0,15\left(mol\right)\)
=> \(n_{H_2SO_4\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\)
PTHH : \(2Na+H_2SO_4-->Na_2SO_4+H_2\) (2)
\(2K+H_2SO_4-->K_2SO_4+H_2\) (3)
Đặt : \(\hept{\begin{cases}n_{Na}=x\left(mol\right)\\n_K=y\left(mol\right)\end{cases}}\) \(\Rightarrow23x+39y=10,1\left(I\right)\)
Theo pt (2); (3) : \(tổng.n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K\)
\(\Rightarrow\frac{x}{2}+\frac{y}{2}=0,15\left(II\right)\)
Theo (I) và (II) => \(\hept{\begin{cases}x=0,1\\y=0,2\end{cases}}\)
Theo pthh (2) : \(n_{Na_2SO_4}=\frac{1}{2}n_{Na}=0,05\left(mol\right)\)
(3) : \(n_{K_2SO_4}=\frac{1}{2}n_K=0,1\left(mol\right)\)
Áp dụng ĐLBTKL : \(m_{hh}+m_{ddH_2SO_4}=m_{ddspu}+m_{H_2}\)
=> \(10,2+100=m_{ddspu}+2\cdot0,15\)
=> \(m_{ddspu}=109,9\left(g\right)\)
=> \(\hept{\begin{cases}C\%_{Na_2SO_4}=\frac{142\cdot0,05}{109,9}\cdot100\%\approx6,46\%\\C\%_{K_2SO_4}=\frac{174\cdot0,1}{109,9}\cdot100\%\approx15,83\%\\C\%_{H_2SO_4}=\frac{98\cdot0,05}{109,9}\cdot100\%\approx4,46\%\end{cases}}\)
c) ktr lại đề nhé. phần 3,7 (g) ra số liệu hơi lẻ :((

3. PTHH: (1) Fe + 2 HCl -> FeCl2 + H2
x______________2x______x___x(mol)
(2) 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
y__________3y_____y___________1,5y(mol)
nH2= 5,6/22,4 =0,25 (mol)
Ta có: \(\left\{{}\begin{matrix}56x+27y=8,3\\x+1,5y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
=> mFe= 0,1.56= 5,6(g) => %mFe=\(\frac{5,6}{8,3}.100\approx67,47\%\\ =>\%mAl\approx32,53\%\)

Gọi M là công thức chung của 2 kim loại kiềm, có phân tử khối trung bình là \(\overline{M}\)
Ta có PTHH: \(2M+2H_2O\rightarrow2MOH+H_2\uparrow\)
\(\Rightarrow n_M=2n_{H_2}=2\cdot\frac{3.36}{22,4}=0,3mol\\ \Rightarrow\overline{M}=\frac{m_M}{n_M}=\frac{8,5}{0,3}=28,3\)
Mà \(M_1< \overline{M}< M_2\Leftrightarrow M_1< 28,3< M_2\)
Dựa vào Bảng tuần hoàn ta thấy M1=23 và M2=39 là phù hợp
Vậy 2 kim loại kiềm lần lượt là Na và K
Gọi a, b lần lượt là số mol của Na và K
Ta có tổng khối lượng 2 kim loại: 23a+39b=8,5(1)
Lại có tổng số mol kim loại: a+b=0,3(2)
Giài hệ phương trình gồm (1), (2) ta được: a=0,2mol và b=0,1mol
Vậy \(\%m_{Na}=\frac{0,2\cdot23}{8,5}\cdot100\%=54,12\%\\ \%m_K=100\%-54,12\%=45,88\%\)

1)\(Mg+HCl\rightarrow MgCl_2+H_2\)
x____________________x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
y ____________________1,5y
Giải hệ phương trình :
\(\left\{{}\begin{matrix}x+\frac{3}{2y}=0,5\\24x+27y=10,2\end{matrix}\right.\rightarrow x=y=0,2\)
\(\%_{Mg}=\frac{0,2.24}{10,2}.100\%=47,1\%\)
\(\rightarrow\%m_{Al}=100\%-47,1\%=52,9\%\)

Gọi A là kim loại trung bình
2A + 2H2O ---> 2AOH + H2
0,3.....................................0,15
nH2 = 0,15 (mol)
=> nA = 0,3 (mol)
\(\Rightarrow\overline{M_A}=\dfrac{m_A}{n_A}=\dfrac{10,1}{0,3}=36,7\left(\dfrac{g}{mol}\right)\)
=> Hai kim loại này là Na, K

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4

nH2 = \(\dfrac{3,36}{22,4}\) = 0,15 (mol)
2X + 2H2O → 2XOH + H2
0,3 ← 0,15 (mol)
MX=\(\dfrac{8,5}{0,3}=28,33g\mol\)
=> chất đó là Na ,K
Gọi Na là x , K là y (mol)
\(\left\{{}\begin{matrix}x+y=0,3\\23x+39y=8,5\end{matrix}\right.=>\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
=>%m Na =\(\dfrac{0,2.23}{8,5}.100=54,12\%\)