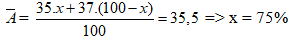Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bài 54:
-Gọi M là kim loại cần tìm
nCO2=\(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
pthh:
MCO3+2HCl\(\rightarrow\) MCl2+CO2\(\uparrow\)+H2O
0,1... ... ... ... ....................0,1(mol)
\(\Rightarrow\) MMCO3=\(\dfrac{m}{n}=\dfrac{10}{0,1}=100\left(g\right)\)
\(\Rightarrow\)MM=40 (Ca)
Chúc bạn học tốt!
nH2=\(\dfrac{1.6,16}{0,082\left(27,3+273\right)}=0,25\left(mol\right)\)
pthh:
M+2HCl\(\rightarrow\) MCl2+H2
0,25... .......... ........0,25(mol)
\(\Rightarrow\) MM=\(\dfrac{10}{0,25}=40\left(g\right)\)
\(\Rightarrow\) M là Ca
Chúc bạn học tốt!
Dẫn A mol CO2 vào dung dịch chứa B mol NaOH. Biện luận số trường hợp xảy ra. Tính m muối theo A và B


1. Phương trình hóa học của các phản ứng xảy ra trong thí nghiệm:
Na2O + H2O → 2NaOH
MgO + H2O → Mg(OH)2
P2O5 + 3H2O → 2H3PO4
2.
Na2O tan tốt trong nước, MgO tan một phần trong nước và làm quỳ chuyển màu xanh
=> Na2O có tính base mạnh hơn MgO, tính base của NaOH mạnh hơn Mg(OH)2
P2O5 tan tốt trong nước, làm quỳ chuyển màu đỏ => P2O5 có tính acid và H3PO4 là một acid.

Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5 (Cl)
Ta có