Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,2_____0,4_____0,2____0,2 (mol)
a, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
b, mZnCl2 = 0,2.136 = 27,2 (g)
c, Đề cho VTT > VLT nên bạn xem lại đề nhé.

a) PTHH: NaOH + Al + H2O -> NaAlO2 + 3/2 H2
b) nH2= 0,6(mol)
-> nAl=0,4(mol) => mAl=0,4.27=10,8(g)
c) nAl=0,18((mol); nNaOH=0,2(mol)
PTHH: 0,18/1 < 0,2/1
=> Al hết, NaOH dư, tính theo nAl.
-> nH2= 3/2. 0,18=0,27(mol)
=>V(H2,đktc)=0,27.22,4= 6,048(l)
\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(...........0.4.........................0.6\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
\(n_{Al}=\dfrac{4.86}{27}=0.18\left(mol\right)\)
\(n_{NaOH}=\dfrac{8}{40}=0.2\left(mol\right)\)
\(2NaOH+2Al+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(2.................2\)
\(0.2...............0.18\)
\(LTL:\dfrac{0.2}{2}>\dfrac{0.18}{2}\)
\(\Rightarrow NaOHdư\)
\(n_{H_2}=0.18\cdot\dfrac{3}{2}=0.27\left(mol\right)\)
\(V_{H_2}=0.27\cdot22.4=6.048\left(l\right)\)

a)
\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ n_{H_2} = n_{Mg} = \dfrac{3,6}{24} = 0,15(mol)\\ b)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Cu} = n_{H_2} = 0,15(mol)\\ \Rightarrow m_{Cu} = 0,15.64 = 9,6(gam)\)

a) PTHH : \(FeO+H_2-t^o->Fe+H_2O\)
\(CuO+H_2-t^o->Cu+H_2O\)
Đặt \(\hept{\begin{cases}n_{FeO}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{cases}}\) => \(72x+80y=11,2\left(I\right)\)
Có : \(m_{O\left(lấy.đi\right)}=m_{giảm}=1,92\left(g\right)\)
=> \(n_{O\left(lấy.đi\right)}=\frac{1,92}{16}=0,12\left(mol\right)\) Vì H% = 80% => Thực tế : \(n_{O\left(hh\right)}=\frac{0,12}{80}\cdot100=0,15\left(mol\right)\)
BT Oxi : \(x+y=0,15\left(II\right)\)
Từ (I) và (II) suy ra : \(\hept{\begin{cases}x=0,1\\y=0,05\end{cases}}\)
=> \(\hept{\begin{cases}m_{FeO}=7,2\left(g\right)\\m_{CuO}=4\left(g\right)\end{cases}}\)
b) PTHH : \(Fe+H_2SO_4-->FeSO_4+H_2\)
BT Fe : \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
Theo pthh : \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
=> \(V_{H_2}=2,24\left(l\right)\)
BT Cu : \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{CR\left(ko.tan\right)}=0,05\cdot64=3,2\left(g\right)\)

\(a,n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ m_{H_2SO_4}=200.19,6\%=39,2\left(g\right)\\ \rightarrow n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
bđ 0,3 0,4
pư 0,3 0,3
spư 0 0,1 0,3 0,3
\(\rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,m_{dd}=19,5+200-0,3.2=218,9\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,3.161}{218,9}.100\%=22,06\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,1.98}{218,9}.100\%=4,48\%\end{matrix}\right.\)

a) Do dd sau pư có 3 chát tan với nồng độ % bằng nhau
=> \(m_{Al_2\left(SO_4\right)_3}=m_{ZnSO_4}=m_{H_2SO_4\left(dư\right)}\)
Gọi số mol Al, Zn là a, b (mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a------->0,5a----->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b----->b--------->b----->b
=> \(\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=342.0,5a=171a\left(g\right)\\m_{ZnSO_4}=161b\left(g\right)\end{matrix}\right.\)
=> 171a = 161b
=> \(\dfrac{a}{b}=\dfrac{161}{171}\) (1)
Có: \(\dfrac{m_{Al}}{m_{Zn}}=\dfrac{27.n_{Al}}{65.n_{Zn}}=\dfrac{27}{65}.\dfrac{161}{171}=\dfrac{483}{1235}\)
b) \(n_{H_2}=1,5a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{161}{825}\left(mol\right)\\b=\dfrac{57}{275}\left(mol\right)\end{matrix}\right.\)
=> \(x=\dfrac{161}{825}.27+\dfrac{57}{275}.65=\dfrac{5154}{275}\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=m_{Al_2\left(SO_4\right)_3}=342.0,5\dfrac{161}{825}=\dfrac{9177}{275}\left(g\right)\)
=> \(m_{H_2SO_4\left(bđ\right)}=98\left(1,5a+b\right)+\dfrac{9177}{275}=\dfrac{22652}{275}\left(g\right)\)
=> \(y=\dfrac{\dfrac{22652}{275}.100}{10}=\dfrac{45304}{55}\left(g\right)\)

a) Do dd sau pư có 3 chát tan với nồng độ % bằng nhau
=> \(m_{Al_2\left(SO_4\right)_3}=m_{ZnSO_4}=m_{H_2SO_4\left(dư\right)}\)
Gọi số mol Al, Zn là a, b (mol)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----->1,5a------->0,5a----->1,5a
Zn + H2SO4 --> ZnSO4 + H2
b----->b--------->b----->b
=> \(\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=342.0,5a=171a\left(g\right)\\m_{ZnSO_4}=161b\left(g\right)\end{matrix}\right.\)
=> 171a = 161b
=> \(\dfrac{a}{b}=\dfrac{161}{171}\) (1)
Có: \(\dfrac{m_{Al}}{m_{Zn}}=\dfrac{27.n_{Al}}{65.n_{Zn}}=\dfrac{27}{65}.\dfrac{161}{171}=\dfrac{483}{1235}\)
b) \(n_{H_2}=1,5a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{161}{825}\left(mol\right)\\b=\dfrac{57}{275}\left(mol\right)\end{matrix}\right.\)
=> \(x=\dfrac{161}{825}.27+\dfrac{57}{275}.65=\dfrac{5154}{275}\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=m_{Al_2\left(SO_4\right)_3}=342.0,5\dfrac{161}{825}=\dfrac{9177}{275}\left(g\right)\)
=> \(m_{H_2SO_4\left(bđ\right)}=98\left(1,5a+b\right)+\dfrac{9177}{275}=\dfrac{22652}{275}\left(g\right)\)
=> \(y=\dfrac{\dfrac{22652}{275}.100}{10}=\dfrac{45304}{55}\left(g\right)\)
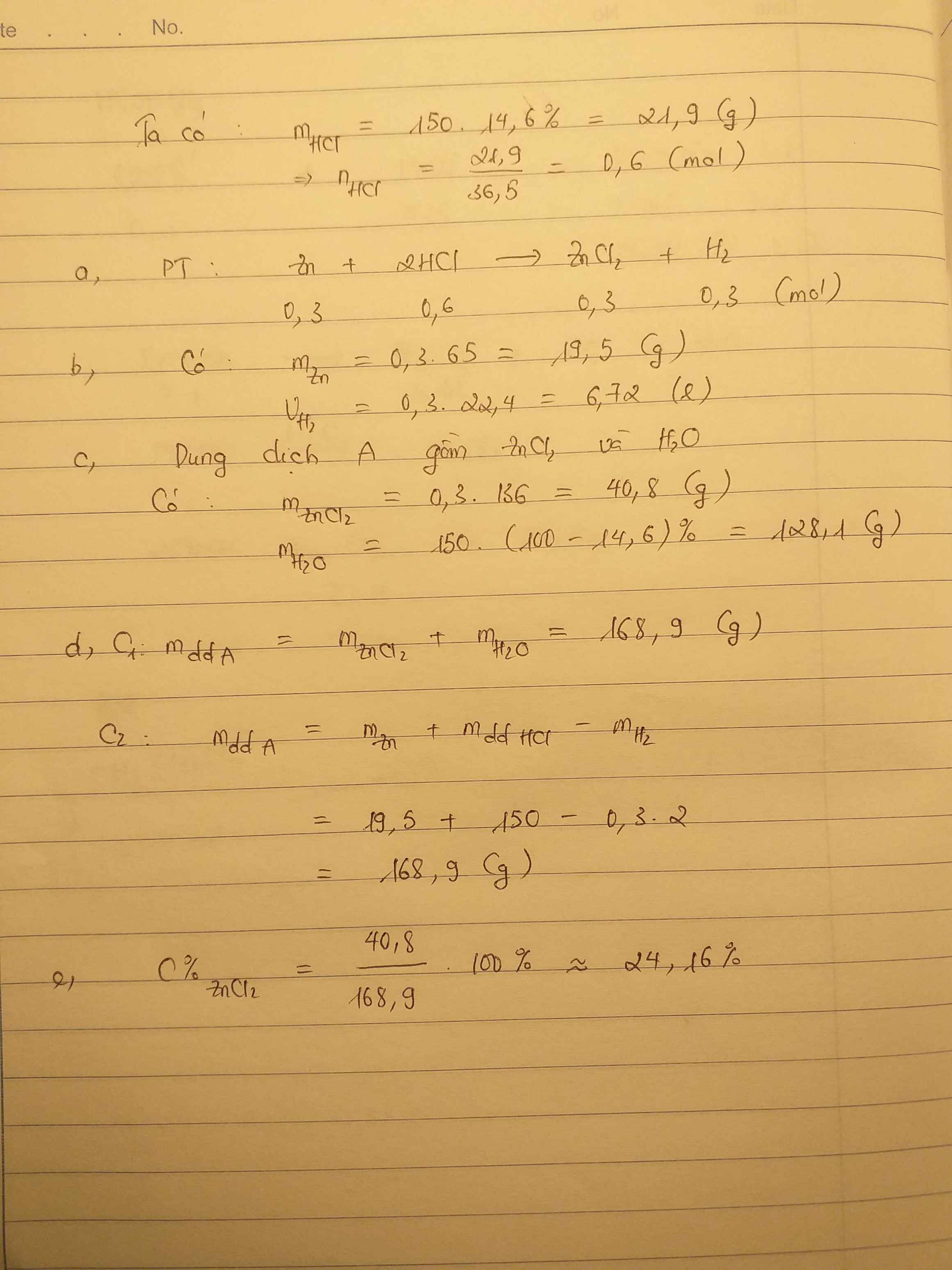
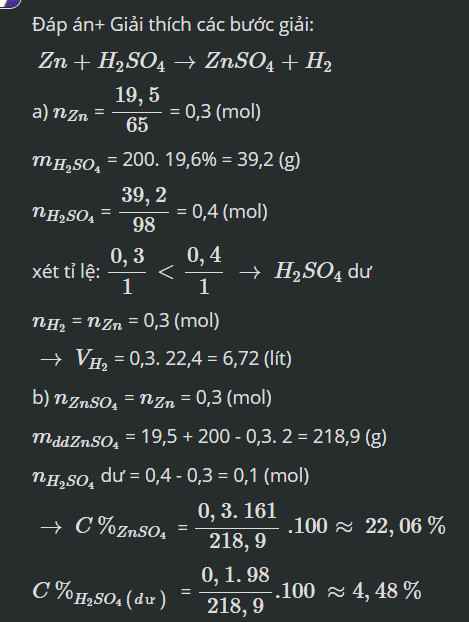
nZn = 19,5/65 = 0,3 (mol)
nH2SO4 = 49/98 = 0,5 (mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
LTL: 0,3 < 0,5 => H2SO4 dư
nH2SO4 (phản ứng) = mZnSO4 = 0,3 (mol)
mH2SO4 (dư) = (0,5 - 0,3) . 98 = 19,6 (g)
mZnSO4 = 0,3 . 161 = 48,3 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)