Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi % đồng vị 21H là a: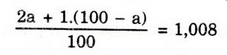
⇒ a = 0,8;
Khối lượng riêng của nước 1 g/ml, vậy 1ml nước có khối lượng 1g. Khối lượng mol phân tử của nước là 18g.


Có \(\overline{A}=\frac{65\left(100-x_1\right)+63.x_1}{100}=63,54\)
\(\Leftrightarrow x_1=73\%\)
\(M_{CuCl_2}=63,54+35,5.2=134,54\left(g/mol\right)\)
\(\Rightarrow\%^{63}Cu=\frac{0,73.63}{134,54}\approx34,1\%\)
Gọi %63Cu =a%
=> 63.a%+(100-a) %=63,54
=>a=73%
M(CuCl2) = 63,54+35,5.2=134,54
=> %63 Cu trong CuCl2= 73%.63/134,54=34,18%

a) Gọi x là % đồng vị 79Br
y là % đồng vị 81Br
Theo đề bài ta có: \(\left\{{}\begin{matrix}\frac{79x+81y}{100}=79,91\\x+y=100\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}79x+81y=7991\\x+y=100\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}x=54,5\\y=45,5\end{matrix}\right.\)
Phần trăm khối lượng của 79Br trong NaBr là:
%m79Br = \(\frac{79.54,5\%}{79,91+22,989}.100\approx41,84\%\)
Phần trăm khối lượng của 79Br trong MgBr2 là:
%m79Br = \(\frac{79.2.54,5\%}{79,91.2+24,31}.100\approx46,766\%\)
Phần trăm khối lượng của 79Br trong AlBr3 là:
%m79Br = \(\frac{79.3.54,5\%}{79,91.3+26,98}.100\approx48,429\%\)