Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

1/ Gọi x, y lần lượt là số mol của Na2CO3 và KHCO3.
Khi cho từ từ HCl vào dung dịch A thì các phản ứng xảy ra lần lượt là :
CO3^2- + H^+ => HCO3-
x ---------> x ----------> x
HCO3^- + H+ => H2O + CO2.
0,045 <--- 0,045 <-------- 0,045
.........HCO3^- + OH- => CO3^2- + H2O.
x+y - 0,045 -------------> x+y-0,045.
Giải hệ: x+y-0,045 = 29,55/197; n HCl = x+ 0,045 = 0,15.
=> x = 0,105 ; y = 0,09.
2/ Nồng độ của HCO3- , CO3^2- lần lượt là 0,225 M; 0,2625 M.
3/ Cho từ từ dung dịch A vào bình đựng 100 ml dung dịch HCl 1,5 M => Các phản ứng xảy ra đồng thời:
CO3^2- + 2 H^+ => H2O + CO2.
HCO3- + H+ => H2O + CO2.
Do tỉ lệ trong hỗn hợp : n CO3^2-/ n HCO3- = 7/6 => 7x*2+6x = 0,15 => x=0,0075.
=> V = 2,184 lít.

Ta có : \(56n.Fe+M.n_H=11,12\left(\odot\right)\)
Phần 1 :
Bảo toàn e : \(2.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_H\)
\(=2.\frac{3,136}{22,4}=0,26\left(1\right)\)
( n là hóa trị của M )
Phần 2 :
Bảo toàn e : \(3.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_{SO2}=2.\frac{4,042}{22,4}\approx0,36\left(2\right)\)
Từ ( 1) và ( 2) \(\rightarrow\frac{n_{Fe}}{2}=0,36-0,28=0,08\left(mol\right)\)
\(\rightarrow n_{Fe}=0,16\left(mol\right)\)
Thay \(\left(\odot\right)\) vào \(\left(1\right)\)
\(\Leftrightarrow\left\{{}\begin{matrix}56.0,16+M.n_M=11,12\\2.0,08+n.\frac{n_M}{2}=0,28\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}n_M=\frac{2,16}{M}\\n_M=\frac{0,24}{n}\end{matrix}\right.\rightarrow\frac{2,16}{M}=\frac{0,24}{n}\)
\(\rightarrow M=\frac{0,16.n}{0,24}=9n\)
Lập bảng :
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
| KL | Loại | Loại | Al |
Vậy M là Al
\(\rightarrow m_{Fe}=56.0,16=8,96\left(g\right)\)
\(\%m_{Fe}=\frac{8,96}{11,12}.100\%=80,58\%\)
\(\%m_{Al}=100\%-80,58\%=19,42\%\)

Đáp án A
Có
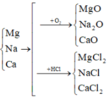
Vì các kim loại trong hỗn hợp X có hóa trị không đổi và khối lượng mỗi phần đều là 11 gam nên số mol electron trao đổi ở mỗi phần là như nhau.
Áp dụng định luật bảo toàn khối lượng ta có:
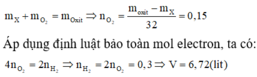



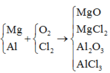
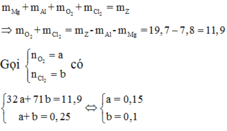
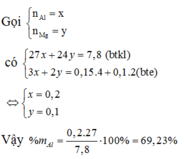


Gọi a, b là mol Mg, Al mỗi phần
- P1:
\(n_{H2}=0,15\left(mol\right)\)
Bảo toàn e: \(2a+3b=0,15.2=0,3\)
- P2:
Khí thoát ra là NO
Bảo toàn e:
\(2a+3b=3n_{NO}\)
\(\Rightarrow0,3=2n_{NO}\)
\(\Rightarrow n_{NO}=0,1\left(mol\right)\)
\(\Rightarrow V=0,1.22,4=2,24\left(l\right)\)