Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\\ a,\%m_{Fe}=\dfrac{0,02.56}{4,36}.100\approx25,688\%\\ \Rightarrow\%m_{Ag}\approx74,312\%\\ b,Ta.thấy:2,18=\dfrac{1}{2}.4,36\\ \Rightarrow m_{hh\left(câuB\right)}=\dfrac{1}{2}.m_{hh\left(câuA\right)}\\ n_{Fe}=\dfrac{0,02}{2}=0,01\left(mol\right)\\ n_{Ag}=\dfrac{2,18-0,01.56}{108}=0,015\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ 2Ag+Cl_2\rightarrow\left(t^o\right)2AgCl\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+\dfrac{1}{2}.n_{Ag}=\dfrac{3}{2}.0,01+\dfrac{1}{2}.0,015=0,0225\left(mol\right)\\ \Rightarrow V_{Cl_2\left(đktc\right)}=0,0225.22,4=0,504\left(l\right)\)
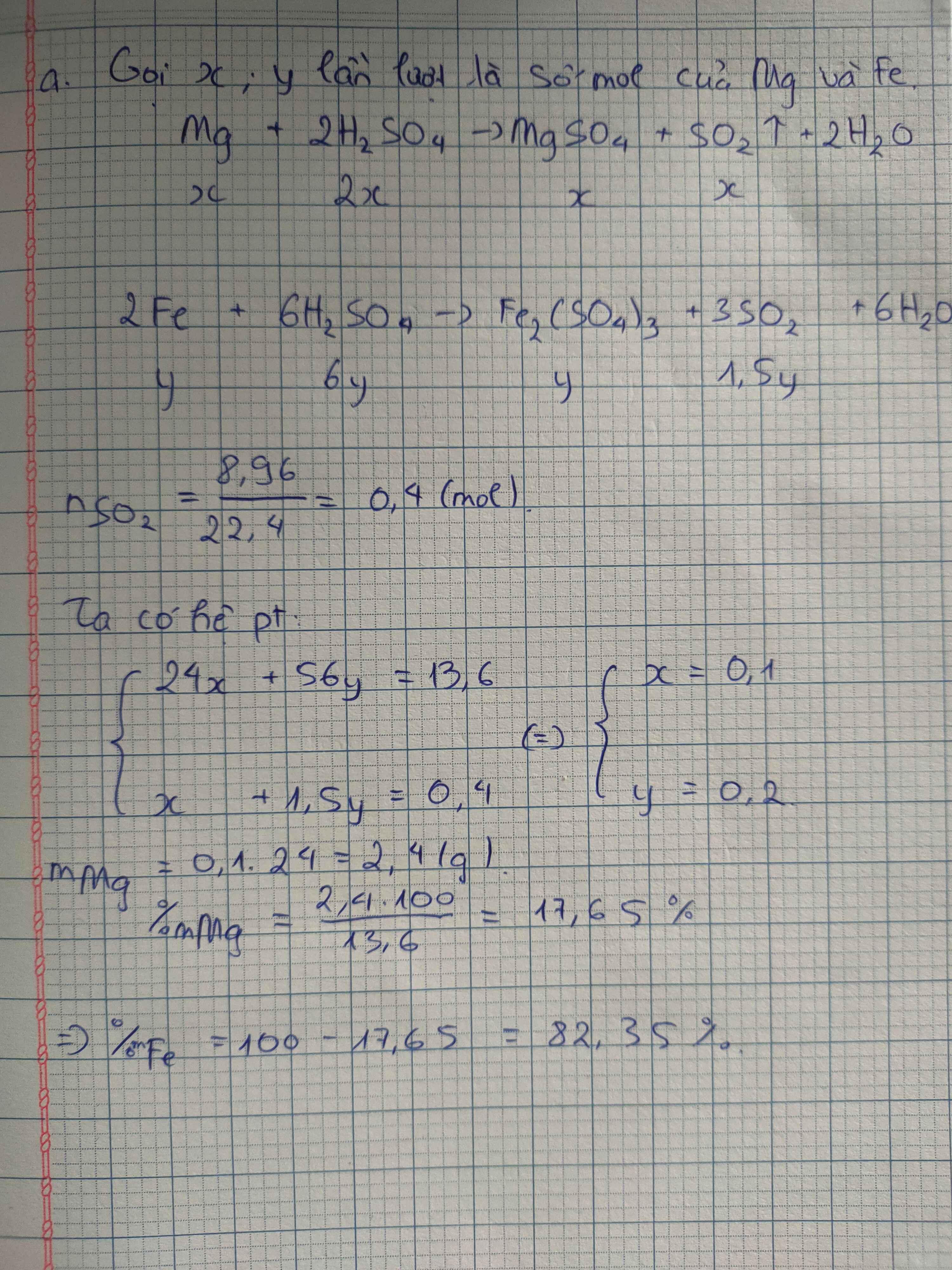

Ta có : \(56n.Fe+M.n_H=11,12\left(\odot\right)\)
Phần 1 :
Bảo toàn e : \(2.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_H\)
\(=2.\frac{3,136}{22,4}=0,26\left(1\right)\)
( n là hóa trị của M )
Phần 2 :
Bảo toàn e : \(3.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_{SO2}=2.\frac{4,042}{22,4}\approx0,36\left(2\right)\)
Từ ( 1) và ( 2) \(\rightarrow\frac{n_{Fe}}{2}=0,36-0,28=0,08\left(mol\right)\)
\(\rightarrow n_{Fe}=0,16\left(mol\right)\)
Thay \(\left(\odot\right)\) vào \(\left(1\right)\)
\(\Leftrightarrow\left\{{}\begin{matrix}56.0,16+M.n_M=11,12\\2.0,08+n.\frac{n_M}{2}=0,28\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}n_M=\frac{2,16}{M}\\n_M=\frac{0,24}{n}\end{matrix}\right.\rightarrow\frac{2,16}{M}=\frac{0,24}{n}\)
\(\rightarrow M=\frac{0,16.n}{0,24}=9n\)
Lập bảng :
Vậy M là Al
\(\rightarrow m_{Fe}=56.0,16=8,96\left(g\right)\)
\(\%m_{Fe}=\frac{8,96}{11,12}.100\%=80,58\%\)
\(\%m_{Al}=100\%-80,58\%=19,42\%\)
cm on bn nh