Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals

H2O ở thể lỏng, trong khi các hợp chất của hiđro khác như BH3, CH4, NH3, H2S, ... đều ở thể khí, vì các phân tử nước hút nhau bằng liên kết hiđro rất mạnh, làm cho các phân tử nước liên kết chặt chẽ. (Còn ở BH3, CH4 chúng không có liên kết hiđro, nên các phân tử không thể liên kết được với nhau).

Đặc điểm hợp chất ion:
+ Các hợp chất ion thường là tinh thể rắn ở điều kiện thường
+ Hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi rất cao
=> Phát biểu (b) và (c) đúng

- Một số hợp chất ion có xung quanh em là:
+ Muối ăn: NaCl
+ Đá vôi: CaCO3
+ Vôi sống: CaO
- Ở điều kiện thường, chúng tồn tại ở thể rắn

- Quan sát Bảng 17.3, nhận thấy trong điều kiện thường có Iodine (I2) là ở thể rắn
- Giải thích:
+ Khối lượng phân tử cao
+ Lực tương tác van der Waals giữa phân tử iodine mạnh

Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.
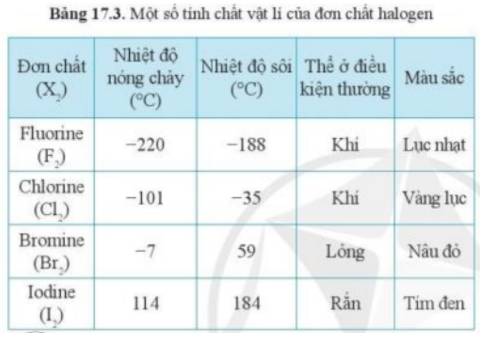
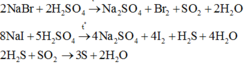
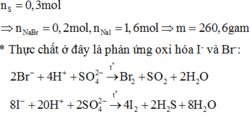
Trong nhóm halogen đi từ trên xuống dưới, khối lượng phân tử và bán kính nguyên tử tăng
=> Lực tăng tác van der Waals tăng
=> Nhiệt độ sôi tăng
=> Astatine trong điều kiện thường tồn tại ở thể rắn