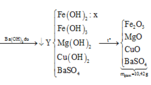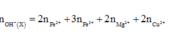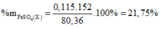Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi Y thành Fe và O ta có sơ đồ:
Sơ đồ ta có:
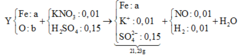
+ Bảo toàn khối lượng muối ta có nFe = a = 0,115 mol.
+ PT theo H+: 0,3 = 2nO + 4nNO + 2nH2.
⇒ nO = 0,12 mol.
● Quy đổi X thành Fe, NO3 và CO3 ta có:
Nung X ta có sơ đồ:
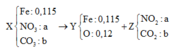
+ Từ MZ = 45 ⇒ nNO2 = nCO2
Û a = b Û a – b = 0 (1)
⇒ Bảo toàn oxi ta có: a + b = 0,12 mol (2)
+ Giải hệ (1) và (2) ⇒ nNO3 = nCO3 = 0,06 mol.
⇒ m = 0,115×56 + 0,06×(62+60) = 13,76
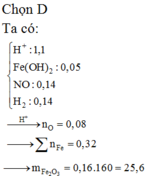
Đáp án A

Đáp án D
Hỗn hợp khí có M = 2.8 = 16
=> có H2 và NO
=> nH2 = nNO, vì có H2
=> 0,01 mol KNO3 hết cho 0,01 mol NO
=> nH2 = 0,01
Trong muối có:
Fe x mol, K+ 0,01 mol, SO4 2- 0,15 mol
m Muối = 56x + 39.0,01 + 96.0,15 = 21,23
=> x = 0,115
=> mFe = 6,44
=> Khí Z gồm NO2 và CO2 có M = 45
=> nNO2 = nCO2 = a
=> trong X có: Fe 0,115 mol, NO3- a mol , CO32- a mol
=> nO = 6a mol ( bảo toàn mol O trong CO3 và NO3)
=> trong Y có 0,115 mol Fe và 2a mol O ( giảm 4a do tạo khí NO2 và CO2)
NO3-+3e+4 H+->NO + 2 H2O
0,01 0,04 0,01
2 H+ + 2e -> H2
0,02 0,01
2 H+ + O -> H2O
4a 2a
nH+ = 0,04 + 0,02 + 4a = 2.0,15
=> a = 0,06
m X = mFe + mNO3 + mCO3
= 6,44 + 62.0,06 + 60.0,06
= 13,76

Đáp án D
+ Khi cho Y tác dụng với KNO 3 , H 2 SO 4 thu được 2 khí có tỉ khối so với H 2 là 8 và có một khí hóa nâu. Suy ra 2 khí là NO và H 2 . Như vậy, trong Y có Fe và Z không chứa O 2 .
+ Sơ đồ phản ứng
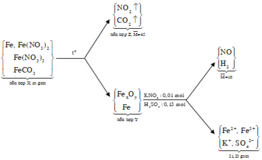
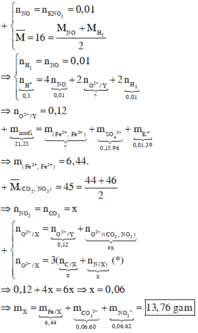

Đáp án A
![]() khí thu được gồm H2 và NO.
khí thu được gồm H2 và NO.
Do vậy NO3- trong Y phản ứng hết.
Giải được số mol NO, H2 thu được đều là 0,01 mol. (Bảo toàn N và đường chéo)
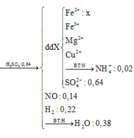
Đặt a, b là số mol của ion Fe2+, Fe3+ trong muối trung hòa. Gọi x là số mol O trong rắn Y.
Bảo toàn e:
![]()
Bảo toàn điện tích:
![]()
=>![]()
Giải được: a=0,055; b=0,06; x=0,12.
Quy đổi hỗn hợp X về Fe 0,115 mol (bảo toàn Fe), NO3 u mol và CO3 v mol.
Khí Z gồm CO2 và NO2.
Bảo toàn O: ![]()
Dựa vào tỉ khối của Z là 45 áp dụng đường chéo giải được u=v0,06.
![]()