Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(19,1gam\) \(:\left\{{}\begin{matrix}Al\\Mg\\Zn\end{matrix}\right.\)\(\underrightarrow{+O_2}\)\(Y:25,5gam\)\(\underrightarrow{+HCl}\left\{{}\begin{matrix}AgCl_3\\MgCl_2\\ZnCl_2\end{matrix}\right.\) + H2 : 0,3 mol
H2O
Áp dụng định luật bảo toàn khối lượng:
\(mO_2=25,5-19,1=6,4gam\) \(\Rightarrow nO_2=0,2\left(mol\right)\)
BTNT O : nH2O = 0,4mol
\(\rightarrow nHCl^-\left(tdOxi\right)=0,8\left(mol\right)\)
\(nH_2=0,3\left(mol\right)\rightarrow nCl^-\left(tdKl\right)=0,6\left(mol\right)\)
\(m_{muối}=19,1+\left(0,8+0,6\right).35,5=68,8\left(g\right)\)

Đáp án C
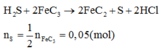
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Đáp án B
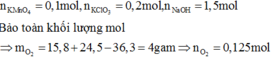
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
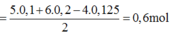


Quy đổi X thành \(\left\{{}\begin{matrix}Fe:x\left(mol\right)\\O:y\left(mol\right)\end{matrix}\right.\)
`=> 56x + 16y = 6,72(2)`
\(M_Y=15.2=30\left(g/mol\right)\Rightarrow Y:NO\\ n_{NO}=\dfrac{0,4958}{24,79}=0,02\left(mol\right)\)
`BTe: 3x - 2y = 0,02.3 = 0,06(2)`
`(1),(2)=>x=0,09;y=0,105`
`=>` \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,045\left(mol\right)\)
`=> m = 0,045.160=7,2(g)`

a) Hỗn hợp A gồm FeS (x mol), Fe dư (y mol) và S dư (0,8 gam)
FeS + 2HCl -------> FeCl2 + H2S
x………………..………x…….x (mol)
Fe + 2HCl -------> FeCl2 + H2
y…………………..…y……..y (mol)
=> Khí D gồm H2S và H2
\(M_D=\dfrac{34x+2y}{x+y}=9.2=18\) (*)
Khí D sục rất từ từ qua dung dịch CuCl2
H2S + CuCl2 -------> CuS + 2HCl
x………………………...x (mol)
=>\(n_{CuS}=x=\dfrac{9,6}{96}=0,1\left(mol\right)\)
Từ (*) => y = 0,1 (mol)
nFe = x+ y = 0,1 + 0,1= 0,2 (mol)
=> m = 0,2 .56 = 11,2 (g)
nS pư = x = 0,1 (mol)
=> p = 0,1.32 + 0,8 = 4 (g)
b) Dung dịch C chứa FeCl2
nFeCl2 = x + y = 0,2 (mol)
FeCl2 + 2NaOH -------> Fe(OH)2 + 2NaCl
0,2................................,.0,2 (mol)
4Fe(OH)2 + O2 + 2H2O -------> 4Fe(OH)3
0,2..............................................0,2 (mol)
2Fe(OH)3 ------> Fe2O3 + 3H2O
0,2........................0,1 (mol)
Chất rắn là Fe2O3
Theo PT => nFe2O3 = 0,1 mol
=> mFe2O3 = 0,1.160 = 16 gam
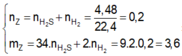
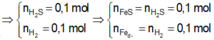
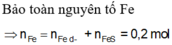
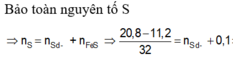
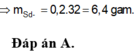

Theo đề bài, sắt còn dư sau khi phản ứng với lưu huỳnh
PTHH: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
Ta có: \(n_{hhkhí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_{Fe\left(3\right)}+n_{FeS}=\Sigma n_{Fe}\)
\(\Rightarrow m_{Fe}=0,12\cdot56=6,72\left(g\right)\)