Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng dung dịch sau phản ứng:
m d d = 200 + 44 x ( g a m )
Ta có phương trình về tổng nồng độ các chất:
84. ( 2 x − 0,2 ) + 106. ( 0,2 − x ) 200 + 44 x .100 = 0,0663 ⇔ x = 0,15
Phân tử khối của muỗi đem nhiệt phân là: M = 15 0,15 = 100 ( g / m o l ) .
Vậy muối là C a C O 3
⇒ Chọn A.

Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
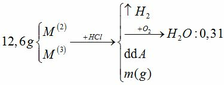
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
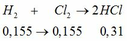
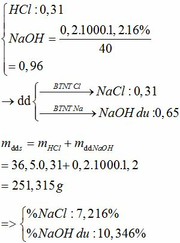

a. Đặt CT muối: \(RCO_3\)
\(RCO_3\rightarrow\left(t^o\right)RO+CO_2\) (1)
\(n_{Ba\left(OH\right)_2}=\dfrac{200.17,1}{171.100}=0,2\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{29,55}{197}=0,15\left(mol\right)\)
`@` TH1: Chỉ tạo ra kết tủa
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,15 0,15 0,15 ( mol )
Theo ptr (1): \(n_{RCO_3}=n_{RO}=n_{CO_2}=0,15\left(mol\right)\)
\(M_{RCO_3}=\dfrac{21}{0,15}=140\) \((g/mol)\)
\(\Leftrightarrow R=80\) ( loại )
`@` TH2: Ba(OH)2 hết
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,2 ( mol )
0,15 0,15 0,15 ( mol )
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
0,05 0,1 ( mol )
Theo ptr (1): \(n_{RCO_3}=n_{RO}=n_{CO_2}=0,15+0,1=0,25\left(mol\right)\)
\(M_{RCO_3}=\dfrac{21}{0,25}=84\) \((g/mol)\)
\(\Leftrightarrow R=24\) `->` R là Mg
\(n_{MgO}=0,25.\left(24+16\right)=10\left(g\right)\)
b.\(n_{MgCO_3}=\dfrac{4,2}{84}=0,05\left(mol\right)\)
\(n_{HCl}=0,05.3=0,15\left(mol\right)\)
\(m_{HCl}=50.1,15=57,5\left(g\right)\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
0,05 < 0,15 ( mol )
0,05 0,1 0,05 0,05 ( mol )
\(m_{ddspứ}=4,2+57,5-0,05.44=59,5\left(g\right)\)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,05.95}{59,5}.100=7,98\%\\\%m_{HCl\left(dư\right)}=\dfrac{\left(0,15-0,1\right).36,5}{59,5}.100=3,06\%\end{matrix}\right.\)

Đặt CT muối \(RCO_3\)
\(RCO_3\rightarrow\left(t^o\right)RO+CO_2\) (1)
\(n_{Ba\left(OH\right)_2}=15.0,01=0,15\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{19,7}{197}=0,1\left(mol\right)\)
`@`TH1: Chỉ tạo ra kết tủa
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,1 0,1 0,1 ( mol )
Theo ptr (1) \(n_{RCO_3}=n_{CO_2}=0,1\left(mol\right)\)
\(M_{RCO_3}=\dfrac{20}{0,1}=200\) \((g/mol)\)
\(\Leftrightarrow R=140\) \((g/mol)\) (loại )
`@`TH2: Tạo ra 2 muối
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,15 ( mol )
0,1 0,1 0,1 ( mol )
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
0,05 0,1 ( mol )
Theo ptr (1): \(n_{RCO_3}=n_{RO}=0,1+0,1=0,2\left(mol\right)\)
\(M_{RCO_3}=\dfrac{20}{0,2}=100\) \((g/mol)\)
\(\Leftrightarrow R=40\) \((g/mol)\) `->` R là Canxi ( Ca )
\(m_{CaO}=0,2\left(40+16\right)=11,2\left(g\right)\)

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
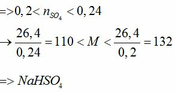
b)
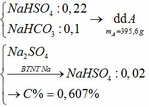
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

a)
$MCO_3 \xrightarrow{t^o} MO + CO_2$
$CO_2 + Ba(OH)_2 \to BaCO_3 + H_2O$
$CO_2 + Ba(OH)_2 \to Ba(HCO_3)_2$
b)
$n_{Ba(OH)_2} = 0,15(mol) ; n_{BaCO_3} = \dfrac{19,7}{197} = 0,1(mol)$
$n_{Ba(HCO_3)_2} = n_{Ba(OH)_2} - n_{BaCO_3} = 0,05(mol)$
$n_{CO_2} = n_{BaCO_3} + 2n_{Ba(HCO_3)_2} = 0,2(mol)$
$n_{MCO_3} = n_{CO_2} = 0,2(mol)$
$m_A = m_{MCO_3} - m_{CO_2} = 20 - 0,2.44 = 11,2(gam)$
c)
$M_{MCO_3} = M + 60 = \dfrac{20}{0,2} = 100$
$\Rightarrow M = 40(Canxi)$
Vậy CTHH : $CaCO_3$

1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]