Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Phương trình hoá học của các phản ứng:
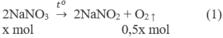
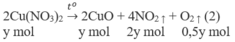
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
![]()
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%

Gọi n K N O 3 = x và n C u ( N O 3 ) 2 = y
Hỗn hợp khí X thu được gồm khí O2 và khí NO2.
Ta có M = 18,8 . 2 = 37,6
Các phản ứng xảy ra như sau:
K N O 3 → t 0 K N O 2 + 1 2 O 2
Mol x x 2
C u ( N O 3 ) 2 → t 0 C u O + 2 N O 2 + 1 2 O 2
Mol y 2y y 2
Đến đây, ta có thể sử dụng 2 cách:
Cách 1: Sơ đồ đường chéo
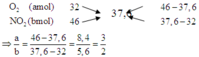
Cách 2: Tính toán thông thường:
Gọi X là tỉ lệ số mol của O2 với tổng số mol hỗn hợp
Suy ra tỉ lệ mol của NO2 với tổng số mol hỗn hợp là (1 – X).
Khi đó M = 32X + 46(1-X) = 37,6 ⇔ X = 0,6
Suy ra, tỉ lệ số mol của NO2 so với tổng số mol khí là 0,4
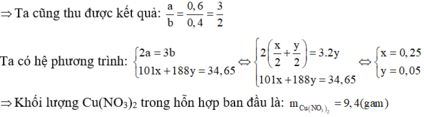
Đáp án D.

Khối lượng muối mỗi phần là 26,1 gam.
Như đã đề cập ở phần lí thuyết, khi nhiệt phân muối nitrat, tùy mức độ hoạt động của kim loại mà muối nitrat kim loại sẽ nhiệt phân từ muối nitrit đến oxit kim loại rồi về kim loại.
Vì thực hiện 2 thí nghiệm ở hai mức nhiệt độ khác nhau thu được kết quả khác nhau nên muối đã nhiệt phân ở các mức khác nhau.
Với thí nghiệm ở nhiệt độ thấp hơn chỉ thu được một khí A nên khí này là O2 và M(NO3)n chỉ nhiệt phân tạo thành muối nitrit M(NO2)n.
Với thí nghiệm ở nhiệt độ cao hơn thu được hỗn hợp khí B, do đó hỗn hợp khí B chứa NO2 và O2. Khi đó M(NO3)n là muối có khả năng nhiệt phân tạo thành oxit kim loại hoặc kim loại.
Các phản ứng xảy ra

Đáp án C.

Gọi số mol NO2, O2 là a, b
Có: \(\dfrac{46a+32b}{a+b}=19,5.2=39\)
=> 7a = 7b
=> a = b
PTHH: 2Mg(NO3)2 --to--> 2MgO + 4NO2 + O2
________0,5a<----------------------a----->0,25a
2NaNO3 --to--> 2NaNO2 + O2
(2b-0,5a)<------------(b-0,25a)
=> mNaNO3 = (2b-0,5a).85 = 127,5a (g)
=> mMg(NO3)2 = 0,5a.148 = 74a (g)
=> \(\left\{{}\begin{matrix}\%NaNO_3=\dfrac{127,5a}{127,5a+74a}.100\%=63,275\%\\\%Mg\left(NO_3\right)_2=\dfrac{74a}{127,5a+74a}.100\%=36,725\%\end{matrix}\right.\)


PTHH: \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\uparrow\)
\(2Zn\left(NO_3\right)_2\underrightarrow{t^o}2ZnO+4NO_2\uparrow+O_2\uparrow\)
\(\left\{{}\begin{matrix}KNO_3:a\left(mol\right)\\Zn\left(NO_3\right)_2:b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}101a+189b=34,05\\\dfrac{a}{2}+2b+\dfrac{b}{2}=0,325\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%KNO_3=\dfrac{0,15.101}{34,05}.100\%=44,5\%\\\%Zn\left(NO_3\right)_2=55,5\%\end{matrix}\right.\)