Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2C2H5OH + 2Na → 2C2H3ONa + H2↑
2CH3 -CH2 -СН2 - ОН + 2Na → 2CH3 -CH2 -СН2 -ONa + H2↑
b) Tính thành phần phần trăm khối lượng mỗi chất
-Theo 2 pthh ở phần a), số mol 2 chất là 2 x 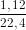 = 0,100 (mol)
= 0,100 (mol)
22,4
-Đặt số mol C2H5OH là x, số mol C3H7OH là 0,100 – x
46,0x + 60,0.(0,100 - x) = 5,30 => x = 0,0500.
Vậy % khối lượng của C2H5OH : 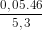 x 100% = 43,4%
x 100% = 43,4%
% khối lượng của C3H7OH : 56,6%.

2C2H5OH + 2Na → 2C2H3ONa + H2↑
2CH3 -CH2 -СН2 - ОН + 2Na → 2CH3 -CH2 -СН2 -ONa + H2↑
b) Tính thành phần phần trăm khối lượng mỗi chất
-Theo 2 pthh ở phần a), số mol 2 chất là 2 x 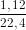 = 0,100 (mol)
= 0,100 (mol)
22,4
-Đặt số mol C2H5OH là x, số mol C3H7OH là 0,100 – x
46,0x + 60,0.(0,100 - x) = 5,30 => x = 0,0500.
Vậy % khối lượng của C2H5OH : 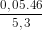 x 100% = 43,4%
x 100% = 43,4%
% khối lượng của C3H7OH : 56,6%.
2C2H5OH + 2Na → 2C2H3ONa + H2↑
2CH3 -CH2 -СН2 - ОН + 2Na → 2CH3 -CH2 -СН2 -ONa + H2↑
b) Tính thành phần phần trăm khối lượng mỗi chất
-Theo 2 pthh ở phần a), số mol 2 chất là 2 x 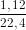 = 0,100 (mol)
= 0,100 (mol)
22,4
-Đặt số mol C2H5OH là x, số mol C3H7OH là 0,100 – x
46,0x + 60,0.(0,100 - x) = 5,30 => x = 0,0500.
Vậy % khối lượng của C2H5OH : 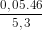 x 100% = 43,4%
x 100% = 43,4%
% khối lượng của C3H7OH : 56,6%.
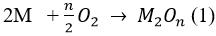
1. Phương trình hoá học của các phản ứng:
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%