Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì trong nguyên tử số hạt electron bằng số hạt proton nên trong R có số hạt proton, notron và electron lần lượt là Z, N và Z.
Theo giả thiết đề bài ta có:
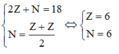
Khi đó cấu hình electron của R là 1s22s22p2.
Do đó số electron độc thân của R là 4.
Đáp án D

Đáp án D
Vì trong nguyên tử số hạt electron bằng số hạt proton nên trong R có số hạt proton, notron và electron lần lượt là Z, N và Z.
Theo giả thiết đề bài ta có: 2 Z + N = 18 N = Z + Z 2 ⇔ Z = 6 N = 6
Khi đó cấu hình electron của R là 1s22s22p2.
Do đó số electron độc thân của R là 4.

Đáp án B.
Tổng số các loại hạt proton, nơtron và electron của R là 18
p + n + e = 18 => 2p + n = 18 (1)
Số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện
n = (p+e)/2 hay n = p = e (2)
Từ (1), (2) ta có p = e = n =6
Cấu hình e của R : 1s2 2s2 2p2. Số electron độc thân = 2

\(\left\{{}\begin{matrix}P+E+N=18\\P=E\\N=\dfrac{1}{2}\left(P+E\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=18\\P=E=N\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=6\\N=6\end{matrix}\right.\\ \Rightarrow A=Z+N=6+6=12\left(đ.v.C\right)\\ \Rightarrow KH:^{12}_6C\)

Cho biết số liệu nguyên tử của nguyên tố x là 13 electron và số proton lớn hơn electron và lớp electron nằm trong nguyên tử

a) Có \(\left\{{}\begin{matrix}p+n+e=2p+n=60\\p=n\end{matrix}\right.=>\left\{{}\begin{matrix}p=e=20\\n=20\end{matrix}\right.\)
=> R là Ca
b)
Cấu hình của Ca: 1s22s22p63s23p64s2
Có 20e => Ca nằm ở ô thứ 20
Có 4 lớp e => Ca thuộc chu kì 4
Có 2e lớp ngoài cùng => Ca thuộc nhóm IIA
c)
Nguyên tử Ca nhường 2e để đạt đến cấu hình bền của khí hiếm, tạo ra ion Ca2+
Cấu hình ion Ca2+ : 1s22s22p63s23p6
d) \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2Ca + O2 --to--> 2CaO
_____0,4<--0,2
=> mCaO = 0,4.40 = 16 (g)

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl
\(\left\{{}\begin{matrix}p+e+n=18\\n=\frac{\left(p+e\right)}{2}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=18\\n=\frac{2p}{2}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=18\\n=p\end{matrix}\right.\Leftrightarrow p=e=n=6\)
\(\rightarrow R:C\left(Cacbon\right)\)
Cấu hình: \(1s^22s^22p^2\)
Chọn B
tổng hạt: 2p + n = 18 (1)
Tổng số hạt không mang điện bằng trung bình cộng tổng số hạt mang điện:
\(\Leftrightarrow n=\frac{2p}{2}\Leftrightarrow2n-2p=0\left(2\right)\)
Từ (1) và (2) ta có hpt:
\(\Rightarrow\left\{{}\begin{matrix}2p+n=18\\2n-2p=0\end{matrix}\right.\) \(\Leftrightarrow p=e=n=6\)
Vì p = 6 nên cấu hình của nguyên tử R là:
\(1s^22s^22p^2\)
Vậy số electron độc thân của R là 2 ( chọn câu b )
( giải thích thêm: Vì \(2s^2\) đã bão hòa )