Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25oC), thể tích 1 mol khí là 24,79 lít.
1 mol khí ở đkc (1bar, 25oC) có thể tích 24,79 lít

đặt \(m_{quặng}\)= a(g).
Ta có: \(m_{CaCO_3}\)= 0,8.a (g)
=> n\(_{CaCO_3}\)=\(\dfrac{0,8.a}{100}\)=0,008.a (mol)
Vì H%=90% => n\(_{CaO}\)\(_{Thu}\)\(_{được}\)=0,008.a.0,9=0,0072.a(mol)
Ta có : n\(_{CaO}\)\(_{Thu}\)\(_{được}\)= \(\dfrac{7000000}{56}\)=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng
đặt ���ặ��mquặng= a(g).
Ta có: �����3mCaCO3= 0,8.a (g)
=> n����3CaCO3=0,8.�1001000,8.a=0,008.a (mol)
Vì H%=90% => n���CaO�ℎ�Thuđượ�được=0,008.a.0,9=0,0072.a(mol)
Ta có : n���CaO�ℎ�Thuđượ�được= 700000056567000000=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng

`#3107.101107`
Tóm tắt:
Cho hỗn hợp khí gồm N2 và O2, biết:
V\(\text{N}_2\) \(=11,2\) l (ở đktc)
V\(\text{O}_2\) `= 33,6` l (ở đktc)
`=>` a, `m` của hh khí?
b, `%` theo m của mỗi khí trong hh?
c, hh khí `>` hay `<` không khí?
_____
Giải:
a,
Số mol của N2 trong hh khí là:
\(n_{N_2}=\dfrac{V_{N_2}}{22,4}=\dfrac{11,2}{22,4}=0,5\left(\text{mol}\right)\)
Số mol của O2 trong hh khí là:
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{33,6}{22,4}=1,5\left(\text{mol}\right)\)
Khối lượng của hh khí N2 và O2 là:
\(m_{hh}=m_{N_2}+m_{O_2}=\left(0,5\cdot28\right)+\left(1,5\cdot32\right)=62\left(g\right)\)
b,
`%` khối lượng của N2 trong hh khí là:
\(\%N_2=\dfrac{0,5\cdot28}{62}\cdot100\approx22,58\%\)
`%` khối lượng của O2 trong hh khí là:
`%O_2 = 100% - 22,58% = 77,42%`
c,
Khối lượng mol của hỗn hợp khí là:
`M_(hh) = ( m_(hh))/( n_(hh)) = 62/(0,5 + 1,5) = 31`\(\left(\text{g/mol}\right)\)
\(d_{hh\text{/}kk}=\dfrac{M_{hh}}{29}=\dfrac{31}{29}\approx1,07\)
`=>` Hỗn hợp khí này nặng hơn không khí
Vậy:
a, `62` g
b, `%N_2 = 22,58%`; `%O_2 = 77,42%`
c, Hỗn hợp khí này nặng hơn không khí.

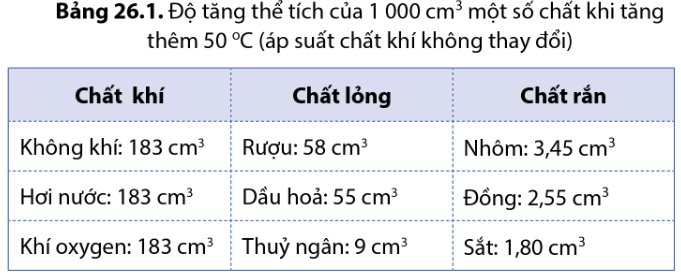
Các chất khí khác nhau nở vì nhiệt giống nhau
Các chất rắn khác nhau nở vì nhiệt khác nhau
Các chất lỏng khác nhau nở vì nhiệt khác nhau
Chất khí có thể nở rất nhiều, và khi nhiệt độ tăng lên đáng kể, chất khí có thể nở tới hàng trăm lần kích thước ban đầu của nó.

1. Đồng hydroxit
2 . Nitrous Oxide
3 . Barium Sulfate
4. Hydro Sulfide

a) Dần xuất hiện kết tủa trắng.
\(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgNO_3\)
\(b)n_{CaCl_2}=\dfrac{2,22}{111}=0,02mol\\ n_{AgNO_3}=\dfrac{1,7}{170}=0,01mol\\ \Rightarrow\dfrac{0,02}{1}< \dfrac{0,01}{2}\Rightarrow CaCl_2.dư\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
0,005 0,01 0,005 0,01
\(m_{AgCl}=0,01.143,5=1,435g\\ c)C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07}=\dfrac{1}{14}M\\ C_{M_{CaCl_2.dư}}=\dfrac{0,02-0,005}{0,07}=\dfrac{3}{14}M\)

P=> 1→1 P2O5 2→2 + H3PO4
H3PO4 3→
=> Na3PO4 4→
+ Ca3(PO4)2
(1) 4P + 5O2 ��→to 2P2O5
(2) P2O5 + 3H2O → 2H3PO4
(3) H3PO4 + NaOH → Na3PO4 + H2O
(4) 2Na3PO4 + 3CaCl2 → 6NaCl + Ca3(PO4)2

nO2=a;nN2=4a��2=�;��2=4�
PTHH: 2SO2+O2V2O5⟷2SO32��2+�2⟷�2�52��3
Bđ: a� a�
Pư: 2x2� x� 2x2�
Sau: a−2x�−2� a−x�−� 2x2�
Bảo toàn khối lượng: mA=mB⇒nA.


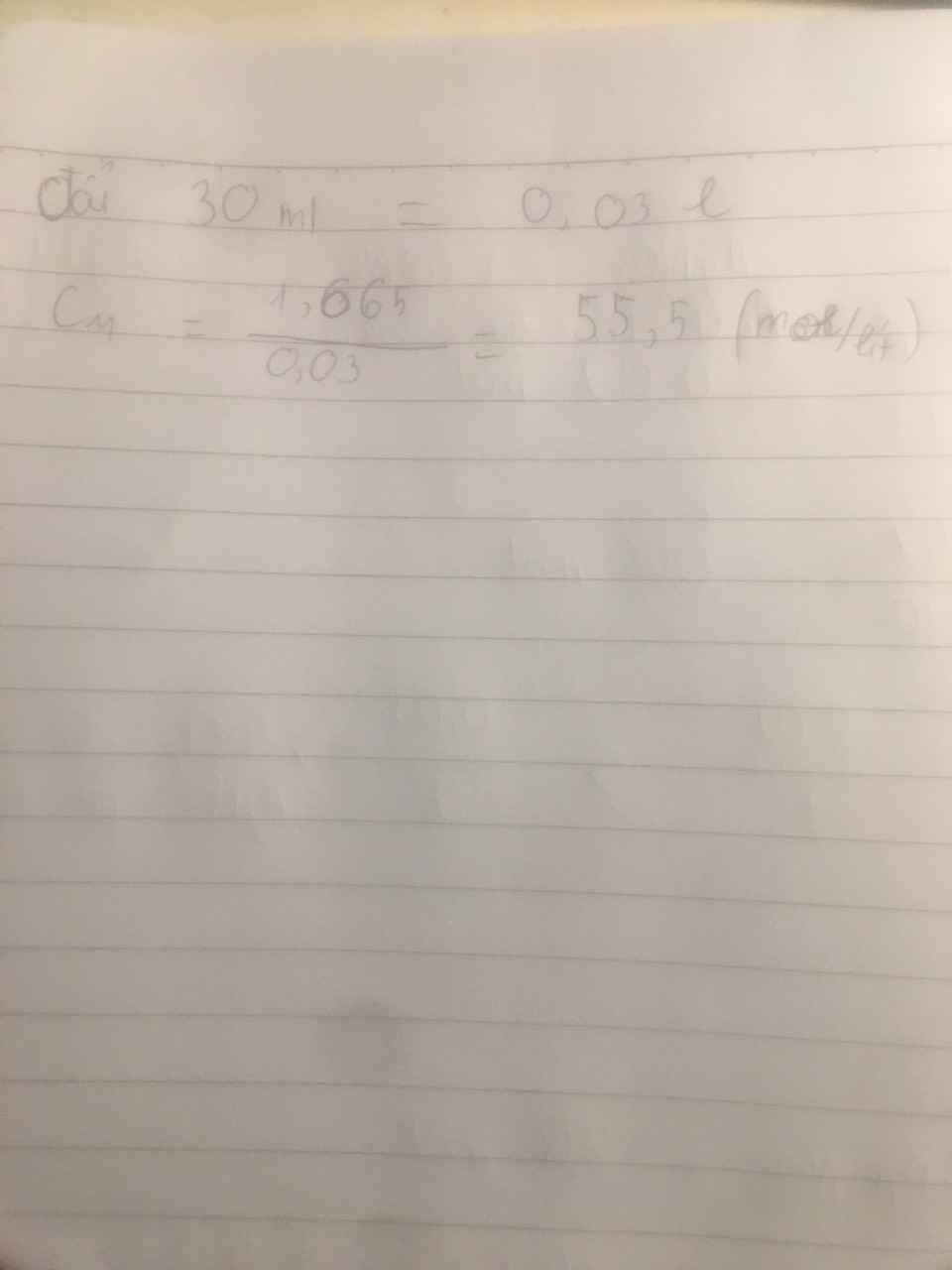
\(V_{N_2}=V_{H_2}\\ \Rightarrow n_{N_2}=n_{H_2}=a\left(mol\right)\left(a>0\right)\\ m_{N_2}=28a\left(g\right);m_{H_2}=2a\left(g\right)\\ Ta.có:\dfrac{m_{N_2}}{m_{H_2}}=\dfrac{28a}{2a}=14\)
Vậy không dùng cân, bằng các CT tính toán ta thấy được 24,79 lít khí N2 sẽ nặng gấp 14 lần 24,79 lít khí H2 ở cùng đk nhiệt độ, áp suất