Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nước tự nhiên có chứa nhiều: Mg(HCO3)2, Ca(HCO3)2, Mg(NO3)2, Ca(NO3)2
Để loại bỏ các ion Mg2+ và Ca2+ có trong muối => ta dùng muối Na2CO3 để kết tủa hết các ion này về dạng MgCO3 và CaCO3
Mg(HCO3)2 + Na2CO3 → MgCO3↓ + 2NaHCO3
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
Mg(NO3)2 + Na2CO3 → MgCO3↓ + 2NaNO3
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Các kết tủa này sẽ lắng xuống, tách ra khỏi nước => loại bỏ được các muối của kim loại Mg2+ và Ca2+ ra khỏi nước

Tham khảo:
a. Dụng cụ, hóa chất:
- Dụng cụ: ống nghiệm, kẹp gỗ.Hóa chất: dung dịch NaOH, dung dịch FeCl3.
- Cách tiến hành:
+ Nhỏ vài giọt dung dịch NaOH vào ống nghiệm có chứa 1 ml dung dịch FeCl3.
+ Lắc nhẹ ống nghiệm.
- Hiện tượng – giải thích: Ta thấy kết tủa nâu đỏ xuất hiện, kết tủa đó là \(Fe\left(OH\right)_3\)
\(PTHH:3NaOH+FeCl_3\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
- Kết luận: Bazơ tác dụng với muối tạo thành muối mới và bazơ mới.
b. Dụng cụ, hóa chất:
- Dụng cụ: ống nghiệm, kẹp gỗ.Hóa chất: dung dịch BaCl2, dung dịch H2SO4 loãng.
- Cách tiến hành:
+Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm có chứa 1 ml dung dịch H2SO4 loãng.
- Hiện tượng – giải thích: Dung dịch xuất hiện kết tủa trắng, là BaSO4.
\(PTHH:BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
- Kết luận: Muối tác dụng với axit tạo thành muối mới và axit mới.

X: NH4HCO3
Y: Mg(HCO3)2
Z: AgNO3
NH4HCO3 + HCl → NH4Cl + H2O + CO2
NH4HCO3 + 2NaOH → NH3 + Na2CO3 + 2H2O
Mg(HCO3)2 + 2HCl → MgCl2 + 2H2O + 2CO2
Mg(HCO3)2 + 2NaOH → Mg(OH)2 + MgCO3 + Na2CO3
AgNO3 + HCl → AgCl + HNO3
2AgNO3 + NaOH → Ag2O + 2NaNO3 + H2O

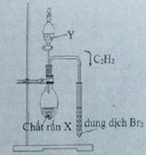
(X, Y) = (CaC2; H2O)
CH≡CH + Br2 → CH(Br2)–CH(Br2)
Dung dịch Br2 nâu đỏ dần nhạt màu rồi mất màu hoàn toàn

*Thí nghiệm 1:
+) Hiện tượng: Xuất hiện chất rắn màu đỏ, dd màu xanh nhạt dần
+) PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
*Thí nghiệm 2
+) Hiện tượng: Xuất hiện kết tủa trắng
+) PTHH: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\downarrow\)
*Thí nghiệm 3
a) Hiện tượng: Xuất hiện kết tủa trắng
PTHH: \(AgNO_3+HCl\rightarrow HNO_3+AgCl\downarrow\)
b) Hiện tượng: Chất rắn tan dần, sủi bọt khí
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
*Thí nghiệm 4: Xem lại đề
*Thí nghiệm 5
+) Hiện tượng: Chất rắn tan dần, dd chuyển sang màu xanh lá cây
+) PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
*Thí nghiệm 6
+) Hiện tượng: Kẽm tan dần, xuất hiện khí
+) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
*Thí nghiệm 7
+) Hiện tượng: Nhôm tan dần, xuất hiện khí
+) PTHH: \(Al+NaOH+H_2O\underrightarrow{t^o}NaAlO_2+\dfrac{3}{2}H_2\uparrow\)

tham khảo
* Tính chất vật lí
Tính dẻo: dùng búa đập một đoạn dây nhôm, đồng; dùng tay uốn cong một đoạn dây đồng
Tính dẫn nhiệt: đun nồi nước,
Tính ánh kim: quan sát các kim loại thấy trên bề mặt sáng lấp lánh
Tính dẫn điện:
* Tính chất hóa học:
Tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao: gỉ sắt
Tác dụng với axit: Cho nhôm tác dụng với axi HCl, nhôm tan, có khí bay ra
Tác dụng với dung dịch muối: cho nhôm tác dụng với CuSO4, nhôm tan có kết tủa mà đỏ