Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nO2=a;nN2=4a��2=�;��2=4�
PTHH: 2SO2+O2V2O5⟷2SO32��2+�2⟷�2�52��3
Bđ: a� a�
Pư: 2x2� x� 2x2�
Sau: a−2x�−2� a−x�−� 2x2�
Bảo toàn khối lượng: mA=mB⇒nA.

V hỗn hợp khí = V oxygen + V nitrogen = 1 x 24,79 + 4 x 24,79 = 123,95 lít

P=> 1→1 P2O5 2→2 + H3PO4
H3PO4 3→
=> Na3PO4 4→
+ Ca3(PO4)2
(1) 4P + 5O2 ��→to 2P2O5
(2) P2O5 + 3H2O → 2H3PO4
(3) H3PO4 + NaOH → Na3PO4 + H2O
(4) 2Na3PO4 + 3CaCl2 → 6NaCl + Ca3(PO4)2

đặt \(m_{quặng}\)= a(g).
Ta có: \(m_{CaCO_3}\)= 0,8.a (g)
=> n\(_{CaCO_3}\)=\(\dfrac{0,8.a}{100}\)=0,008.a (mol)
Vì H%=90% => n\(_{CaO}\)\(_{Thu}\)\(_{được}\)=0,008.a.0,9=0,0072.a(mol)
Ta có : n\(_{CaO}\)\(_{Thu}\)\(_{được}\)= \(\dfrac{7000000}{56}\)=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng
đặt ���ặ��mquặng= a(g).
Ta có: �����3mCaCO3= 0,8.a (g)
=> n����3CaCO3=0,8.�1001000,8.a=0,008.a (mol)
Vì H%=90% => n���CaO�ℎ�Thuđượ�được=0,008.a.0,9=0,0072.a(mol)
Ta có : n���CaO�ℎ�Thuđượ�được= 700000056567000000=125000(mol).
=> 0,0072.a=125000 => a=17361111,11(g)
=17,36111 ( tấn)
Vậy cần 17,36111 tấn quặng

a) Dần xuất hiện kết tủa trắng.
\(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgNO_3\)
\(b)n_{CaCl_2}=\dfrac{2,22}{111}=0,02mol\\ n_{AgNO_3}=\dfrac{1,7}{170}=0,01mol\\ \Rightarrow\dfrac{0,02}{1}< \dfrac{0,01}{2}\Rightarrow CaCl_2.dư\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
0,005 0,01 0,005 0,01
\(m_{AgCl}=0,01.143,5=1,435g\\ c)C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07}=\dfrac{1}{14}M\\ C_{M_{CaCl_2.dư}}=\dfrac{0,02-0,005}{0,07}=\dfrac{3}{14}M\)

1. Đồng hydroxit
2 . Nitrous Oxide
3 . Barium Sulfate
4. Hydro Sulfide

a/ Hỗn hợp khí N2 và CO nặng hơn không khí. Khí CO có khối lượng riêng lớn hơn khí N2, do đó hỗn hợp này có khối lượng riêng lớn hơn không khí.
b/ Hỗn hợp đồng thể tích hai khí Cl2 và H2 nhẹ hơn không khí. Cả hai khí Cl2 và H2 đều có khối lượng riêng nhỏ hơn không khí, do đó hỗn hợp này có khối lượng riêng nhỏ hơn không khí.

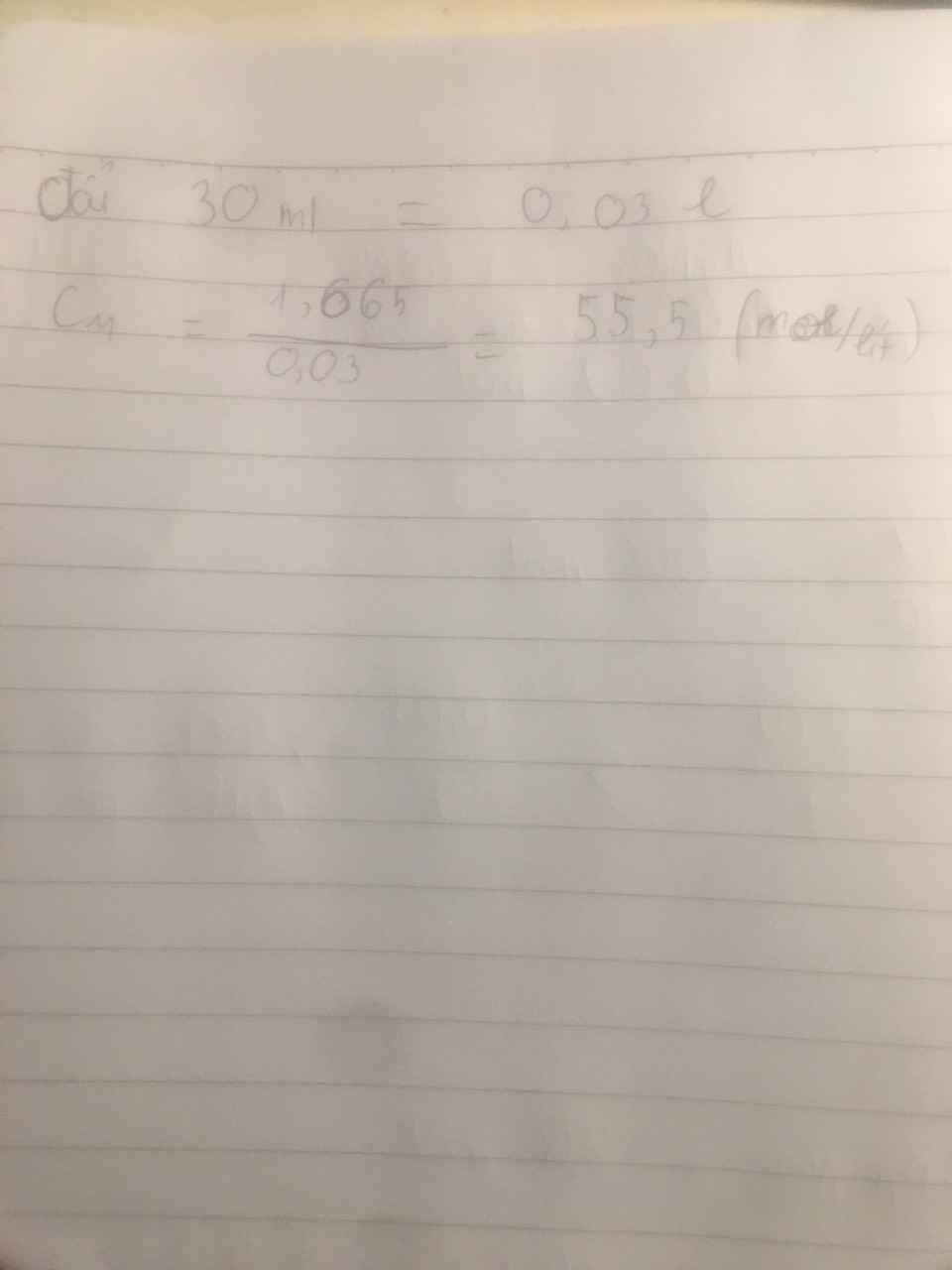
Ta có: 2nH2 + 30nNO = 4,9 (1)
\(n_{H_2}+n_{NO}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,2\left(mol\right)\\n_{NO}=0,15\left(mol\right)\end{matrix}\right.\)
Dạ em cảm ơn chị ạ nhưng em chị có thể giải thích rõ hơn phần suy ra đáp án không ạ?