
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Tính acid của một chất càng mạnh nếu phân tử đó càng dễ phân li thành ion H+.
⟹ HF khó phân li thành ion H+ hơn so với HCl.
- Các phân tử hydrogen halide thì chỉ HF có liên kết hydrogen, các liên kết này sẽ làm cho nguyên tử H bị giữ chặt hơn ⟹ Khó tách ion H+ hơn so với HCl.
Vì vậy tính acid của HF yếu hơn rất nhiều so với HCl.

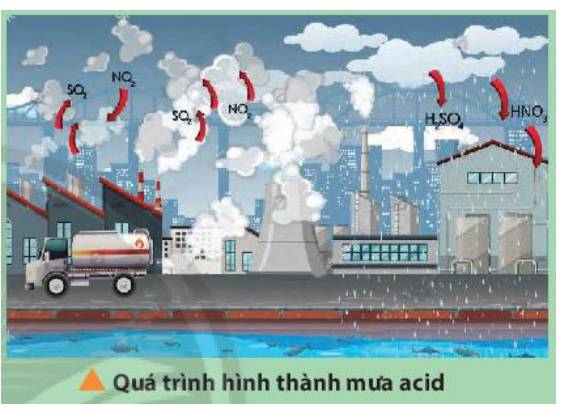
Nghiên cứu để tìm ra giải pháp nhằm giảm thiểu tác hại của mưa acid thuộc phương pháp nghiên cứu ứng dụng, nhằm mục đích giải quyết các vấn đề mưa acid gây nên (ảnh hưởng xấu đến môi trường, con người...)

- Tính acid phụ thuộc vào khả năng tách H của acid. Phân tử nào càng dễ tách H thì tính acid càng mạnh
- Trong nhóm halogen, từ F đến I có độ âm điện giảm dần
=> Khả năng liên kết H-X giảm dần
=> Khả năng tách H trong HX tăng dần
=> Tính acid tăng dần
=> Dung dịch HF có tính acid yếu nhất

- Nguyên tố chu kì 2 gồm: Li, Be, B, C, N, O, F và Ne.
- Li và Be là kim loại nên hydroxide của chúng là: LiOH và Be(OH)2.
- Tính acid của LiOH < Be(OH)2, tính base của LiOH > Be(OH)2.
- Se (Z = 34): 1s22s22p63s23p64s23d104p4
Cấu hình e rút gọn: [Ar] 3d104s24p4
- Se ở ô số 34, chu kì 4, thuộc nhóm VIA
- Acid của Se là: H2SeO4, là một acid yếu.