Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$a) 2Mg + O_2 \xrightarrow{t^o} 2MgO$
b) $n_{Mg} = \dfrac{2,4}{24} = 0,1(mol) ; n_{O_2} = \dfrac{1,6}{32} = 0,05(mol)$
Ta thấy :
$n_{Mg} : 2 = n_{O_2} : 1$. Chứng tỏ phản ứng vừa đủ
c) Không có chất nào dư
d) $n_{MgO} = n_{Mg} = 0,1(mol)$
$m_{MgO} = 0,1.40 = 4(gam)$

\(PTHH:2Zn+O_2->2ZnO\)
BĐ 0,4 0,3 (mol)
PU 0,4---->0,2--->0,4 (mol)
CL 0------->0,1---->0,4 (mol)
a)
\(n_{Zn}=\dfrac{m}{M}=\dfrac{26}{65}=0,4\left(mol\right)\\ n_{O_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\dfrac{n_{Zn}}{2}< \dfrac{n_{O_2}}{1}\left(\dfrac{0,4}{2}< \dfrac{0,3}{1}\right)\)
=> Zn hết, O2 dư ( tính theo Zn)
b)
\(m_{ZnO}=n\cdot M=0,4\cdot\left(65+16\right)=32,4\left(g\right)\)

\(m_{\text{dung dịch sau phản ứng}}=m_{Al\left(pư\right)}+m_{dd_{H_2SO_4}}-m_{H_2}\)
Khối lượng Al là khối lượng dư sau phản ứng chứ sao tính bằng H2SO4 được em.
Maximilian Anh ơi tính cái dư hay là cái hết ạ phải tính khói lượng AL dư hay là tính khối lượng AL dựa vào H2SO4 ạ

`FeO + H_2` $\xrightarrow[]{t^o}$ `Fe + H_2 O`
`a) n_[H_2] = [ 3,36 ] / [ 22,4 ] = 0,15 (mol)`
`n_[FeO] = [ 14,2 ] / 72 = 71 / 360`
Ta có: `[ 0,15 ] / 1 < [ 71 / 360 ] / 1`
`=> FeO` dư
Theo `PTHH` có: `n_[FeO_\text{(p/ứ)}] = n_[H_2] = 0,15 (mol)`
`=> n_[FeO_\text{(dư)}] = 71 / 360 - 0,15 = 17 / 360 (mol)`
_______________________________________________
`b)` Theo `PTHH` có: `n_[Fe] = n_[H_2] = 0,15 (mol)`
`=> m_[Fe] = 0,15 . 56 = 8,4 (g)`

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH : Fe + 2HCl -> FeCl2 + H2
0,2 0,4 0,2
Xét tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\) => Fe đủ , HCl dư
\(m_{HCl\left(dư\right)}=\left(0,5-0,4\right).36,5=3,65\left(g\right)\)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)

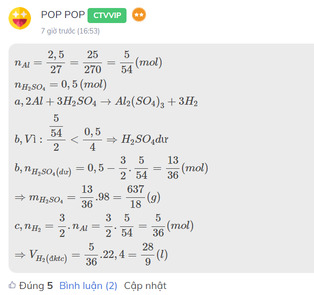
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\\
pthh:2Na+2H_2O->2NaOH+H_2\)
0,1 0,1 0,05
=> \(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
=> \(m_{NaOH}=0,1.40=4\left(g\right)\)
6/ (bài 5 bạn kia làm rồi)
PTHH: SO3 + H2O ---> H2SO4
0,1 0,1
sp là axit, nhận biết bằng QT, axit làm QT chuyển đỏ
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
0,1 0,1 0,1
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=0,1.65=6,5\left(g\right)\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)


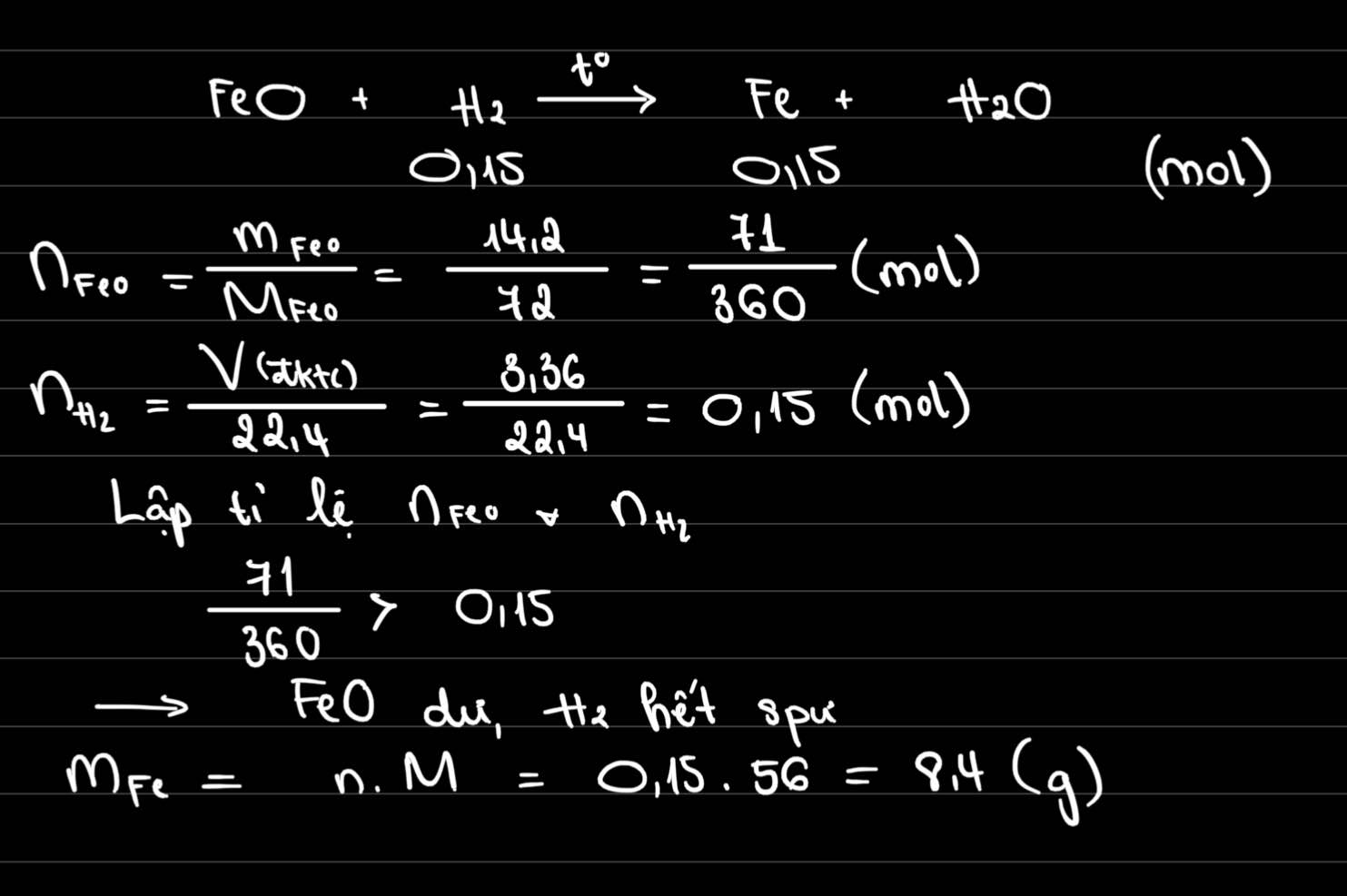
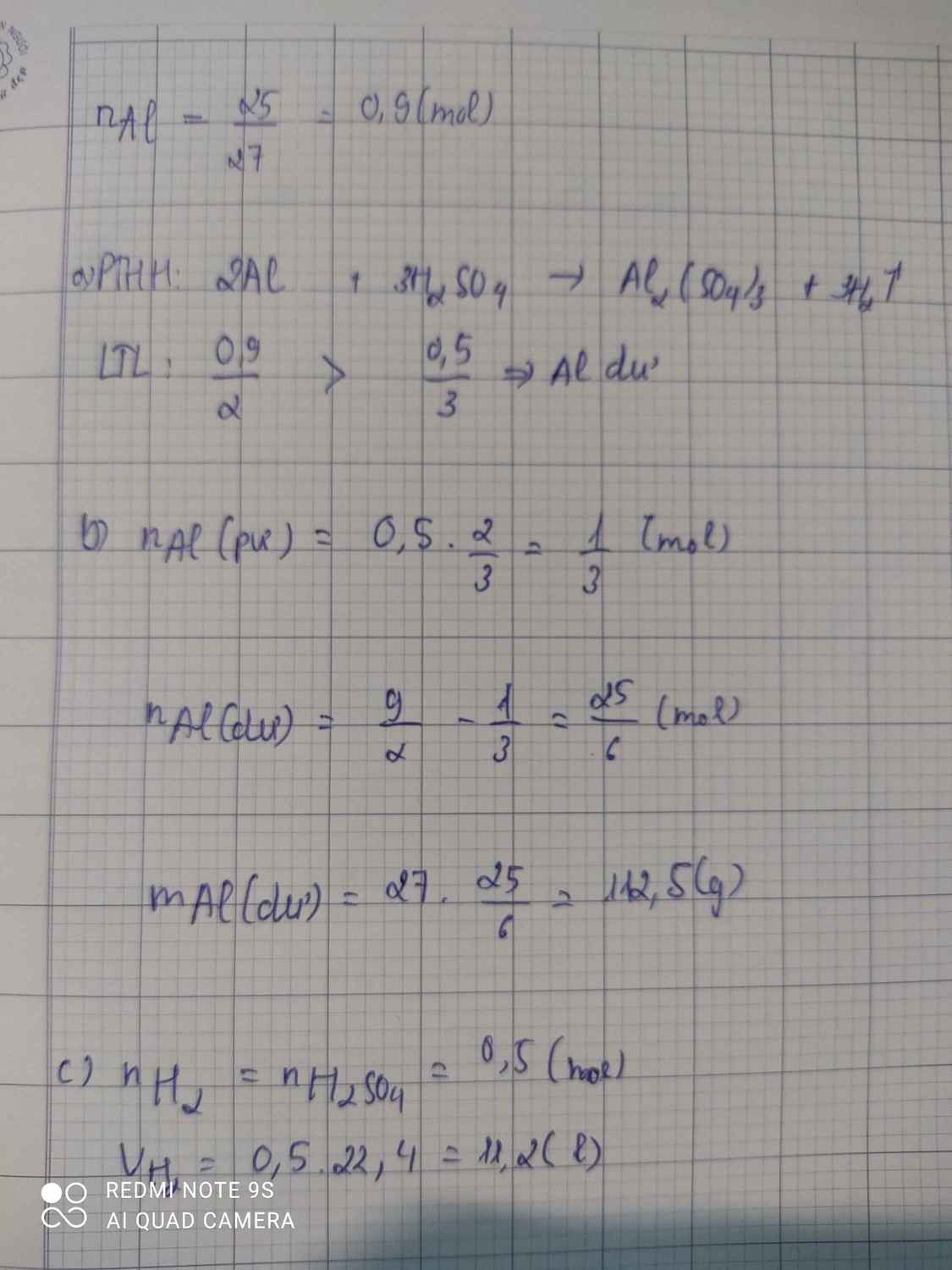
balck rose số mol pứ hết
cảm ơn ạ