Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cái này thì mình giải thích đơn giản là có nghĩa ví dụ đề cho nO2=0.3mol. Nhưng khi ta tính theo phương thì nO2=0.1mol.Từ đây ta suy ra được là O2 dư .Bạn cứ làm nếu thấy nO2 pứng nhỏ hơn nO2 đề thì nó dư thôi. Nếu ko hiểu nữa thì inbox riêng cho mình nha .facebook Lê Đoàn Hương Giang .mình 2k7 nha

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 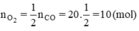
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
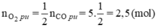 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

Em để ý trên phương trình nhé.
Tổng số mol Ca(OH)2 bằng số mol CaO + số mol Ca
\(Ca + 2H_2O \to Ca(OH)_2 + H_2(1)\\ CaO + H_2O \to Ca(OH)_2(2)\)
Theo PTHH (1) : 1 mol Ca tạo thành được 1 mol Ca(OH)2
Chứng tỏ \(n_{Ca(OH)_2(1)} = n_{Ca}\)
Theo PTHH (2) : 1 mol CaO tạo thành được 1 mol Ca(OH)2
Chứng tỏ \(n_{Ca(OH)_2(2)} = n_{CaO}\)
Do đó :
\(n_{Ca(OH)_2\ thu\ được} = n_{Ca(OH)_2(1)} + n_{Ca(OH)_2(2)} = n_{Ca} + n_{CaO}\)

Nôm na như thế này :
Giả sử CT : \(A_xB_y\)
Có khối lượng mol là : M
\(\%A=\dfrac{x\cdot A}{M}\cdot100\%=a\%\)
\(\Rightarrow M=\dfrac{x\cdot A\cdot100\%}{a\%}\left(1\right)\)
\(\%B=\dfrac{B\cdot y}{M}\cdot100\%=b\%\)
\(\Leftrightarrow M=\dfrac{B\cdot y\cdot100\%}{b}\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(\dfrac{x\cdot A\cdot100\%}{a\%}=\dfrac{y\cdot B\cdot100\%}{b\%}\)
\(\Leftrightarrow\dfrac{x\cdot A}{a}=\dfrac{y\cdot B}{b}\)
\(\Leftrightarrow x\cdot A\cdot b=y\cdot B\cdot a\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{B\cdot a}{A\cdot b}=\dfrac{a}{A}:\dfrac{b}{B}\)
Tới đây là hiểu rồi chứ nhỉ !
Thanh Lam Là sao bạn chả hiểu gì cả mình đang nói cái CT trên mà bạn đang làm cái gì vậy

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{H_2SO_4}=0.3\cdot1=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1........0.1...........0.1.......0.1\)
\(\Rightarrow H_2SO_4dư\)
\(n_{H_2SO_4\left(dư\right)}=0.3-0.1=0.2\left(mol\right)\)
\(n_{ZnSO_4}=n_{H_2}=0.1\left(mol\right)\)
\(C_{M_{ZnSO_4}}=\dfrac{0.1}{0.3}=0.33\left(M\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2}{0.3}=0.66\left(M\right)\)
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{Zn} = \dfrac{6,5}{65} = 0,1 < n_{H_2SO_4} =0,3 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} = n_{ZnSO_4} = n_{Zn} = 0,1(mol)\\ n_{H_2SO_4\ dư} = 0,3 - 0,1 = 0,2(mol)\\ c) C_{M_{ZnSO_4}} = \dfrac{0,1}{0,3} = 0,33M\\ C_{M_{H_2SO_4}} = \dfrac{0,2}{0,3} = 0,67M\)

\(N_2+3H_2\leftrightarrow2NH_3\\ n_{NH_3}=a\left(mol\right)\\ n_{sau}=14=9-\dfrac{1}{2}a+6-\dfrac{3}{2}a+a\\ a=1\\ n_{N_2}:1>n_{H_2}:3\\ H=\dfrac{1}{\dfrac{2}{3}.6}.100\%=25\%\)

Zn+2HCl----->ZnCl2+H2
a) n Zn=13/65=0,2(mol)
Lập tỉ lệ
0,2>0,3/2(0,15)
----> Zn dư
b) Theo pthh
n Zn=1/2n HCl=0,15(mol)
n Zn dư=0,2-0,15=0,05(mol)
m Zn dư=0,05.65=3,25(g)
c) Theo pthh
n H2=1/2n HCl=0,15(mol)
V H2=0,15.22,4=3,36(l)
d) Theo pthh
n ZnCl2=1/2n HCl=0,15(mol)
m ZnCl2=0,15.136=20,4(g)
Chúc bạn học tốt



Ta thấy :
$2n_{H_2} = 0,04< n_{HCl} = 0,6$ nên HCl dư.