
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
2Na + 2H2O → 2NaOH + H2
6NaOH + Al2(SO4)3 → 2Al(OH)3 + 3Na2SO4
b)
4H2SO4 + Fe3O4 → Fe2(SO4)3 + FeSO4 + 4H2O
c)
2H2SO4 + MnO2 + 2NaCl → Cl2 + 2H2O + MnSO4 + Na2SO4
a;
2Na + 2H2O -> 2NaOH + H2
6NaOH + Al2(SO4)3 -> 2Al(OH)3 + 3Na2SO4
NaOH + Al(OH)3 -> NaAlO2 + 2H2O
b;
Fe3O4 + 4H2SO4 -> FeSO4 + Fe2(SO4)3 + 4H2O
c;
MnO2 + 2NaCl + 2H2SO4 -> MnSO4 + Na2SO4 + Cl2 + 2H2O

Điều chế HCl:
KCl + H2SO4 -> KHSO4 + HCl
Điều chế Cl2:
MnO2 + 4KCl + 2H2SO4 -> MnSO4 + 2K2SO4 + Cl2↑ + 2H2O
2KCl + 2H2O (điện phân dd có màng ngăn) -> KOH + Cl2↑ + H2↑
*Điều chế HCl
KCl + H2SO4 ---> NaHSO4 + HCl(lỏng)
2KCl + H2SO4 ---> Na2SO4 + 2HCl↑(đk: nhiệt độ ≥400oC
*Điều chế Cl2:
KCl + H2O ---> Cl2 + H2 + KOH
(đk : nhiệt độ 75oC, chất xúc tác anod trơ, điện phân có màng ngăn)
KCl ---> Cl2 + K
(đk: điện phân nóng chảy)
2H2SO4 + 2KCl + MnO2 ---> Cl2 + 2H2O + MnSO4 + K2SO4

H2SO4 loãng có thể phản ứng với các Kim loại hoạt động ( mạnh hơn H2 ) tạo ra muối SO4 của KL đó và khí H2 bay lên , nhưng không thể phản ứng với các kim loại kém hoạt động ( yếu hơn H2 )
H2SO4 đặc có thể phản ứng cả với KL hoạt động lẫn kim loại không hoạt động ( trừ Au và Pt ) sinh ra muối SO4 của KL đó với hóa trị cao nhất của Kl . khí SO2 và H2O .

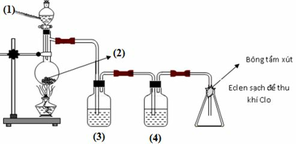
a, Dẫn qua H2SO4 đặc để giữ lại hơi nước lẫn trong khí clo sau khi điều chế (làm khô khí clo).
b, Khí clo thu đc không hoàn toàn tinh khiết vì axit clohidric đặc dễ bay hơi nên dòng khí clo có thể còn lẫn hơi HCl trong đó.
c, Clo và HCl là 2 khí rất độc nên đặt miếng bông tẩm NaOH ở miệng bình thu khí clo nhằm ngăn hai khí này rò rỉ ra ngoài.
hình như là MnSO4, H2O,SO2
MnO2+H2SO4--->MnSO4+H2O