
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_6+Cl_2\underrightarrow{as}C_2H_5Cl+HCl\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_6+Br_2\rightarrow C_2H_5Br+HBr\)
\(C_3H_4+2Br_2\rightarrow C_3H_4Br_4\)
\(C_3H_4+4O_2\underrightarrow{t^o}3CO_2+2H_2O\)

Cho nước vào các hóa chất dạng bột
+ Tan : Na2O, NaCl
\(Na_2O+H_2O\rightarrow2NaOH\)
+ Tan, có vẩn đục : CaO
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
+ Không tan: Al2O3, Fe2O3, MgO
Cho quỳ tím vào 2 dung dịch tan
+ Quỳ hóa xanh: Na2O
+ Không đổi màu : NaCl
Cho từ từ đến dư dung dịch của lọ Na2O vào các mẫu thử không tan
+ Tan : \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
+ Không tan :Fe2O3, MgO
Quan sát màu sắc của 2 chất rắn không tan
+ Chất bột có màu nâu đỏ là Fe2O3
+ Chất bột có màu trắng là MgO

Câu 40. \(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right);n_{HCl}=\dfrac{36,5}{36,5}=1\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Theo đề: 0,5mol .....1mol
Lập tỉ lệ : \(\dfrac{0,5}{1}< \dfrac{1}{1}\)=> Sau phản ứng NaOH hết, HCl dư
=> Thử môi trường sau phản ứng bằng quỳ sẽ có màu đỏ
Câu 41.
nNaOH=0,3.0,5=0,15(mol);nHCl=0,3.1=0,3(mol)
PTHH: NaOH + HCl → NaCl + H2O
Theo đề:0,15mol ....0,3mol
Lập tỉ lệ :\(\dfrac{0,15}{1}< \dfrac{0,3}{1}\)=> Sau phản ứng NaOH hết, HCl dư
=> Dung dịch sau phản ứng làm quỳ tím hóa màu đỏ

a.
- Thử với lượng nhỏ mỗi chất.
| dd HCl | dd H2SO4 | |
| dd BaCl2 | Không hiện tượng | Kết tủa trắng |
\(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow\left(trắng\right)+2HCl\)
b.
- Thử với lượng nhỏ mỗi chất.
| dd KCl | dd K2SO4 | |
| dd BaCl2 | Không hiện tượng | Kết tủa trắng |
\(K_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow\left(trắng\right)+2KCl\)
c.
a.
- Thử với lượng nhỏ mỗi chất.
| dd K2SO4 | dd H2SO4 | |
| Qùy tím | Không đổi màu | Hóa đỏ |



\(2/\\ \text{Cho quỳ tím vào 4 mâu:}\\ \text{- Hoá xanh: }KOH; Ba(OH)_2(1)\\ \text{- Không hiện tượng: } KCl; K_2SO_4 (2)\\ \text{Đổ nhóm 1 vào nhóm 2: }\\ \text{- Tạo kết tủa: } Ba(OH)_2; K_2SO_4\\ \to Ba(OH)_2 \text{ ở nhóm 1 và } K_2SO_4 \text{ ở nhóm 2}\\ \text{- Không hiện tượng: } KCl; KOH (2)\\ \to KOH \text{ ở nhóm 1 và } KCl \text{ ở nhóm 2}\\ Ba(OH)_2+K_2SO_4 \to BaSO_4+2KOH\)
\(3/\\ 2Fe(OH)_3 \xrightarrow{t^{o}} Fe_2O_3+3H_2O\\ n_{Fe_2O_3}=0,15(mol)\\ \to n_{Fe(OH)_3}=0,15.2=0,3(mol)\\ m_{Fe(OH)_3}=0,3.107=32,1(g)\)
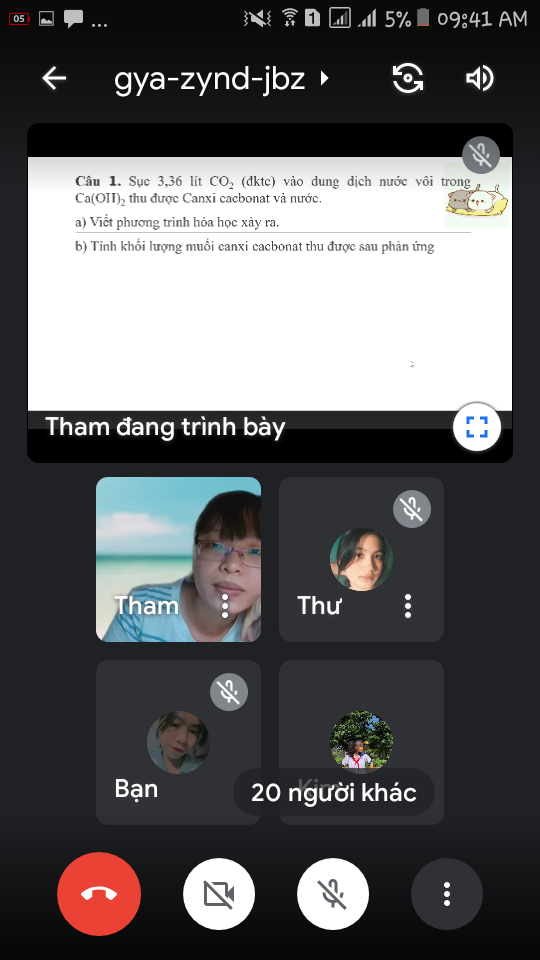














\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ a.CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\\ b.0,15......0,15.........0,15.......0,15\left(mol\right)\\ m_{CaCO_3}=0,15.100=15\left(g\right)\)
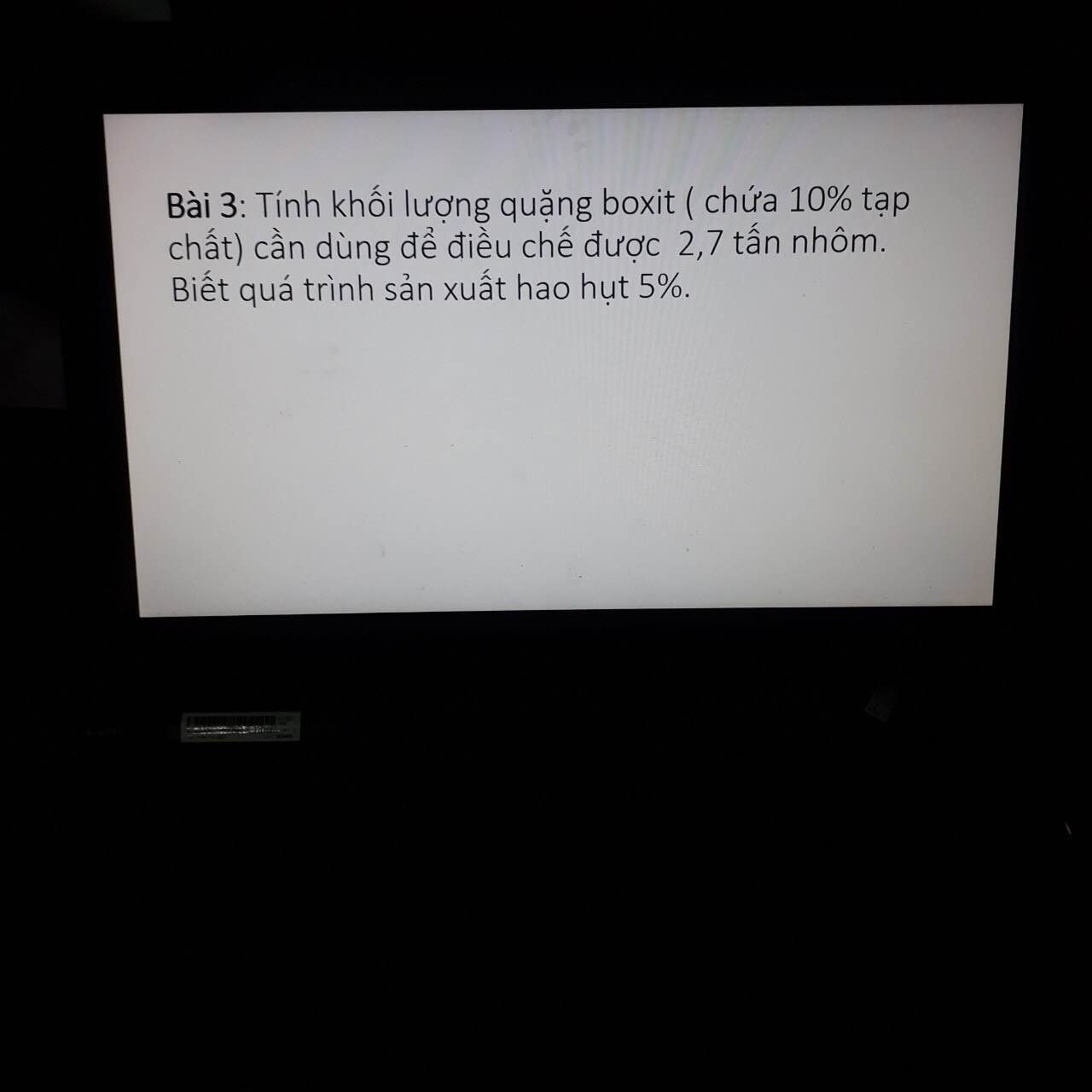
Bài 1 :
\(n_{CO2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O|\)
1 1 1 1
0,15 0,15
b) \(n_{CaCO3}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{CaCO3}=0,15.100=15\left(g\right)\)
Chúc bạn học tốt