Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
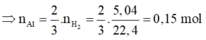
⇒ m F e 2 O 3 (bđ) = 20,05 - 0,15.27 = 16g
⇒ n F e 2 O 3 (bđ) = 16/160 = 0,1 mol
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ m F e 2 O 3 (dư) = 0,025.160=4g
⇒ Chọn A.

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
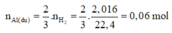
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
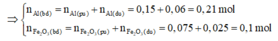
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

\(\left(a\right)2Al+3H_2O\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ \left(b\right)n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\\ n_{Al}=\dfrac{0,6.2}{3}=0,4mol\\ m_{Al}=0,4.27=10,8g\\ \left(c\right)n_{O_2}=\dfrac{4,8}{32}=0,15mol\\ 4Al+3O_2\underrightarrow{t^0}2Al_2O_3\\ \Rightarrow\dfrac{0,4}{4}>\dfrac{0,15}{3}\Rightarrow Al.dư\\ n_{Al_2O_3}=\dfrac{0,15.2}{3}=0,1mol\\ m_{oxit}=m_{Al_2O_3}=0,1.102=10,2g\)
a: \(2Al+3H_2SO_4\rightarrow1Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,4 0,6 0,2 0,6
b: \(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
=>\(n_{Al}=0.4\left(mol\right)\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
c: \(4Al+3O_2\rightarrow2Al_2O_3\)
0,4 0,2
\(m_{Al_2O_3}=0.2\left(27\cdot2+16\cdot3\right)=0.2\cdot102=20.4\left(g\right)\)

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

3