Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B

→ 45 , 2 g c r Y → + H 2 S O 4 0 , 35 m o l S O 2
Giả sử chất rắn Y gồm Ag (a mol), Cu (2a mol)
m Y = m Ag + m Cu ⇔ 108 a + 64 . 2 a = 45 , 2 ⇔ a = 0 , 192 mol
n e n h ư ờ n g = n A g + 2 n C u = 0 , 192 + 2 . 2 . 0 , 192 = 0 , 96 > 2 n S O 2 = 2 . 0 , 35 = 0 , 7 m o l
=> Mg và Al phản ứng hết và Cu2+ dư.
Ta có hệ pt:
108 n Ag + 64 n Cu = 45 , 2 n Ag + 2 n Cu = 2 n SO 2 = 0 , 7 ⇔ n Ag = 0 , 3 = a n Cu = 0 , 2

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`
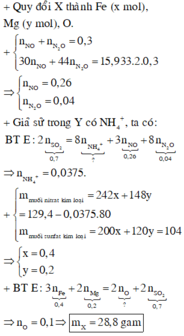

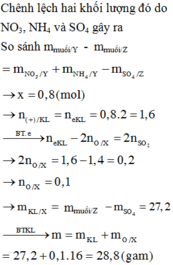
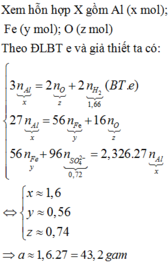
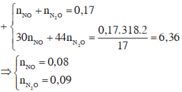
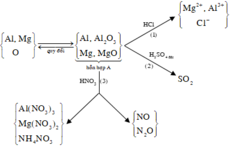


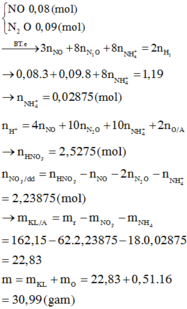
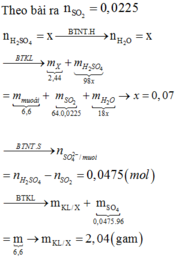
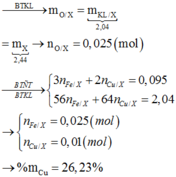

nMgSO4 = nMg = 0,4
nH2SO4 ban đầu = 0,5
Bảo toàn nguyên tố S ⇒ nS/khí = nH2SO4 – nMgSO4 = 0,1 mol
Cho e:
Mg0 → Mg2+ + 2e
0,4 → 0,8 (mol)
Nhận e:
S+6 + k(e) → Sx
0,02k ← 0,02 (mol)
Áp dụng định luật bảo toàn e có: 0,1k = 0,8 ⇒ k =8
k= 8 ⇒ x= -2 ⇒ Khí đó là H2S
Đáp án C.