Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
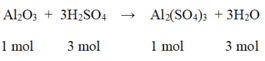
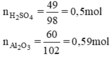
So sánh tỉ lệ 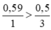 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
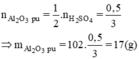
mAl2O3 (dư) = 60 - 17 = 43(g)

Phương trình phản ứng hóa học:
Al2O3 + 3H2SO4 → Al2(SO4) + 3H2O
102 g 3. 98 = 294 g
Theo phương trình phản ứng ta thấy, khối lượng axit sunfuric nguyên chất tiêu thụ lớn gấp hơn hai lần khối lượng oxit. Vì vậy, 49 gam H2SO4 nguyên chất sẽ tác dụng với lượng nhôm (III) oxi nhỏ hơn 60gam
Vật chất Al2O3 sẽ còn dư và axit sunfuric phản ứng hết.
102 g Al2O3 → 294 g H2SO4
X g Al2O3 → 49g H2SO4
Lượng chất Al2O3 còn dư là: 60 – x = 60 - = 43 g
Trần Thu Hà copy từ trang hoc khác đó cô @Cẩm Vân Nguyễn Thị

Mình thay trên câu a luôn nhé.
5. Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
a) Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
b) Khối lượng của FeCl2 tạo thành sau p.ứng là :
mFeCl2 = 0,1.127 = 12,7 (g)
c) Thể tích khí Hiđro (đktc) tạo thành sau p.ứng là :
VH2 = 0,1.22,4 = 2,24 (l)
4. Công thức của B là : NaxCyOz
+ \(m_{Na}=\frac{106.43,6}{100}\approx46\left(g\right)\)
\(m_C=\frac{106.11,3}{100}\approx12\left(g\right)\)
\(m_O=\frac{106.45,3}{100}\approx48\left(g\right)\)
+ \(n_{Na}=\frac{46}{23}=2\left(mol\right)\)
\(n_C=\frac{12}{12}=1\left(mol\right)\)
\(n_O=\frac{48}{16}=3\left(mol\right)\)
Suy ra trong một p.tử h/c có 2 n.tử Na, 1 n.tử C và 3 n.tử O.
\(\Rightarrow\) CTHH của hợp chất B là Na2CO3.

Đề 15:
1) Theo đề bài , ta có:
NTK(Y)= 2.NTK(Ca)= 2.40=80 (đvC)
=> Nguyên tố Y là brom, KHHH là Br.
2) - Đơn chất là chất do 1nguyên tố tạo thành.
VD: O3; Br2 ; Cl2;......
- Hợp chất là những chất do 2 hay nhiều nguyên tố hóa học trở lên tạo thành.
VD: NaCl, KMnO4, CuSO4, H2O;....
3) Khôi lượng mol? tự trả lời đi !
a) Khối lượng mol của phân tử gồm 2C và 4H
Có nghĩa là khối lượng mol của C2H4
\(M_{C_2H_4}\)= 2.12+4.1=28 (g/mol)
\(M_{H_2S}\)=2.1+32=34(g/mol)

`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`

PTHH:Al2O3+3H2SO4\(\underrightarrow{ }\)Al2(SO4)3+3H2O
Theo PTHH:294 gam H2SO4 cần 102 gam Al2O3
Vậy:49 gam H2SO4 cần 17 gam Al2O3
Sau phản ứng, Al2O3 thừa:60-17=43(gam)
I. hoàn thành các phương trình hóa học sau, ghi rõ điều kiện xày ra (nếu có)
1. 2 H2 + 02 -to> 2 H20
2. Fe +2 HCL -> FeCl2 + H2
3. P2O5 +3 H2O -> 2 H3PO4
4. FE2O3 +3 H2 -to-> 2 FE + 3 H2O
II. Sắt (III) oxit tác dụng với axit sunfuric theo phương trình phản ứng như sau:
Fe2O3 = 3H2SO4 -> Fe2(SO4)3 + 3H2O
Tính khối lượng muối sắt (III) sunfat được tạo thành nếu đã sử dụng 58,8 gan axit sunfuric nguyaan chất tác dụng với 60g sắt (III) oxit. Sau phản ứng, chất nào còn dư? Khối lượng dư của chất đó là bao nhiêu
----
PTHH: Fe2O3 + 3 H2SO4 -> Fe2(SO4)3 + 3 H2O
nH2SO4=0,6(mol); nFe2O3= 0,375(mol)
Ta có: 0,375/1 > 0,6/3
=> H2SO4 hết, Fe2O3 dư, tính theo nH2SO4
=> nH2SO4(dư)= 0,375 - 0,6/3 = 0,175(mol)
=> mH2SO4(dư)= 0,175. 98=17,15(g)