Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{CO_2} = \dfrac{44}{44} = 1(mol)\\ n_{H_2O} = \dfrac{19,8}{18} = 1,1(mol)\\ n_X = n_{H_2O} - n_{CO_2} = 1,1 -1 = 0,1(mol)\\ \Rightarrow \%V_A = \dfrac{0,1}{0,4}.100\% = 25\%\)
b)
Ctrung bình = \( \dfrac{n_{CO_2}}{n_X} = \dfrac{1}{0,4} = 2,5\)
Suy ra : n < 2,5 < m
Vậy n = 2
A : C2H6 ; B : C2H2
b)
\(n_C = n_{CO_2} = 1\\ n_H = 2n_{H_2O} = 1,1.2 = 2,2\\ \Rightarrow m_X = m_C + m_H = 1.12 + 2,2 = 14,2(gam)\\ \)
Suy ra :
\(m_C = 14,2.39,43\% = 5,6(gam)\\ m_A = 0,1.30 = 3(gam)\\ m_B = 14,2 - 5,6 - 3 = 5,6 \Rightarrow n_B = \dfrac{5,6}{28} = 0,2(mol)\)
nC = nX - nA -nB = 0,4 - 0,1 - 0,2 = 0,1
Suy ra : 0,1.14m = 5,6 ⇒ m = 4 (C4H8)
a)
CnH2n+2 + O2 → nCO2 + (n+1)H2O (1)
CnH2n + O2 → nCO2 + nH2O (2)
CmH2m + O2 → mCO2 + mH2O (3)
Ta thấy khi đốt B và C số mol CO2 thu được bằng số mol H2O
=> Tổng số mol H2O - tổng số mol CO2 = nA
<=> \(\dfrac{19,8}{18}\)- \(\dfrac{44}{44}\)= 0,1 = nA
=> %VA = \(\dfrac{0,1}{0,4}\).100%= 25%
b) Số nguyên tử C trung bình = \(\dfrac{nCO_2}{nX}\)= 2,5
Mà n < m => n = 2
CTPT của A là C2H6 , của B là C2H4
c) Ta có m hỗn hợp X = mC + mH = 1.12 + 1,1.2 = 14,2 gam
=> mC(CmH2m) = mX.39,43% = 5,6 gam
=> mB = mX - mA - mC = 14,2 - 0,1.30 - 5,6 = 5,6 gam
=> nB = \(\dfrac{5,6}{28}\)= 0,2 mol
Mà nX = 0,4 => nC = 0,4 - nA - nB = 0,4 - 0,1 - 0,2 = 0,1 mol
<=> MC = \(\dfrac{5,6}{0,1}\)= 56 (g/mol)
=> 12m + 2m =56 <=> m = 4
Vậy CTPT của C là C4H8

Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

Gọi \(\left\{{}\begin{matrix}n_{C_nH_{2n+2}}=a\left(mol\right)\\n_{C_mH_{2m}}=b\left(mol\right)\end{matrix}\right.\)
=> \(a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(n_{CO_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
\(n_{H_2O}=\dfrac{30,6}{18}=1,7\left(mol\right)\)
Bảo toàn C: an + bm = 1,5
=> 2an + 2bm = 3 (1)
Bảo toàn H: 2an + 2a + 2bm = 3,4 (2)
(2) - (1) => 2a = 0,4
=> a = 0,2 (mol)
\(\%V_{C_nH_{2n+2}}=\dfrac{0,2}{0,5}.100\%=40\%\)
\(\%V_{C_mH_{2m}}=100\%-40\%=60\%\)

a, b là số mol X và Y
\(n_{O_2}=0,55mol;n_{CO_2}=0,35\)
\(C_nH_{2n+2}+\left(\dfrac{3n+1}{2}\right)O_2\rightarrow nCO_2+\left(n+1\right)H_2O\)
a--------------\(\dfrac{3n+1}{2}a\) ------------\(na\)
\(C_mH_{2m-2}+\left(\dfrac{3m-1}{2}\right)O_2\rightarrow mCO_2+\left(m-1\right)H_2O\)
b---------------\(\dfrac{3m-1}{2}b\)------------\(mb\)
Ta có:
\(\left\{\begin{matrix}a+b=0,25\\\dfrac{3n+1}{2}a+\dfrac{3m-1}{2}b=0,55\\na+mb=0,35\end{matrix}\right.\)\(\Leftrightarrow\left\{\begin{matrix}a+b=0,25\\a-b=0,05\\na+mb=0,35\end{matrix}\right.\)\(\Leftrightarrow\left\{\begin{matrix}a=0,15\\b=0,1\\3n+2m=7\end{matrix}\right.\)
\(\Rightarrow n=1;m=2\)\(\Rightarrow X:CH_4;Y:C_2H_2\)

Sửa đề: 15,86 (l) O2 → 15,68 (l) O2
Gọi CTPT của X và Y là CnH2n+2O và CmH2m-2O4 (m ≥ 2) có số mol lần lượt là x (mol) và y (mol)
Ta có: \(n_{O_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)\)
\(n_{CO_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(n_{H_2O}=\dfrac{11,7}{18}=0,65\left(mol\right)\)
BTNT O, có: x + 4y = 0,55.2 + 0,65 - 0,7.2 = 0,35 (1)
BTNT C, có: nx + my = 0,55 (2)
BTNT H, có: 2nx + 2x + 2my - 2y = 0,65.2 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
BTKL, có: mM + mO2 = mCO2 + mH2O ⇒ mM = 13,5 (g)
⇒ 0,15.(14n + 18) + 0,05.(14m + 62) =13,5
⇒ 3n + m = 11
- TH1: n = 1 ⇒ m = 8 (tm) → CTPT: CH4O và C8H14O4.
- TH2: n = 2 ⇒ m = 5 (tm) → CTPT: C2H6O và C5H8O4.
- TH3: n = 3 ⇒ m = 2 (tm) → CTPT: C3H8O và C2H2O4.
b, Ta có: \(n_{R\left(COOH\right)_2}=0,05\left(mol\right)\)
\(n_{OH^-}=n_{NaOH}+n_{KOH}=0,1.1+0,1.0,5=0,15\left(mol\right)\)
\(R\left(COOH\right)_2+2OH^-\rightarrow R\left(COO^-\right)_2+2H_2O\)
0,05___________0,1_________________0,1 (mol)
→ Bazo dư nên sau khi cô cạn dd N, chất rắn khan thu được gồm: muối, bazo dư.
- TH1:
BTKL, có: mC8H14O4 + mNaOH + mKOH = mcr khan + mH2O
⇒ mcr khan = 0,05.174 + 0,1.40 + 0,05.56 - 0,1.18 = 13,7 (g) = a
- TH2:
BTKL, có: mC5H8O4 + mNaOH + mKOH = mcr khan + mH2O
⇒ mcr khan = 0,05.132 + 0,1.40 +0,05.56 - 0,1.18 = 11,6 (g) = a
- TH3:
BTKL, có: mC2H2O4 + mNaOH + mKOH = mcr khan + mH2O
⇒ mcr khan = 0,05.90 + 0,1.40 + 0,05.56 - 0,1.18 = 9,5 (g) = a

n CO2 = 0,6 mol => m CO2 = 0,6 . 44 = 26,4 g
n H2O = 0,8 mol
=> n ancol = 0,8 – 0,6 = 0,2 mol
Bảo toàn khối lượng : m Oxy + m hỗn hợp = m CO2 + m H2O
=> m oxy + 15,2 = 26,4 + 14,4 => m Oxy = 25,6 g => n O2 = 0,8 mol
Bảo toàn nguyên tố oxy : n O ( trong hỗn hợp ) + 2 n O2 ( đốt cháy ) = n CO2 . 2 + n H2O
=> 2 n axit + n ancol + 0,8 . 2 = 0,8 + 0,6 .2
=> n Axit = 0,1 mol ( vì n ancol = 0,2 mol )
=> n axit . ( n + 1 ) + n ancol . m = n CO2
=> 0,1 . (n + 1 ) + 0,2 . m = 0,6
=> n +2 m = 5
TH1 m = 2 thì n = 1 TH2: m = 1 thì n = 3
C2H5OH và CH3COOH ( loại vì có số C giống nhau đều là 2 C )
hoặc C3H7COOH và CH3OH ( chọn )
C3H7COOH + CH3OH → C3H7COOCH3 + H2O
0,1 0,2 => 0,1 mol
=> n thực tế = 0,09 mol
=> m C3H7COOCH3 = 0,09 . 102 = 9,18 g

nCO2 = 2,688/22,4 = 0,12 mol; nH2O = 2,52/18 = 0,14 mol
Ta thấy nH2O>nCO2 => ancol là ancol no, đơn chức, mạch hở
Gọi công thức chung của ancol là CkH2k+2O (k €N*)
Giả sử:
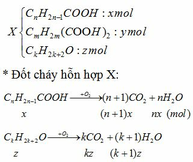
=> nH2O – nCO2 = nx – (n+1)x + (m+1)y – (m+2)y + (k+1)z – kz
=> 0,14 – 0,12 = -x - y + z hay -x - y + z = 0,02 (1)
BTNT ta tính được số mol của các nguyên tố:
nC = nCO2 = 0,12 mol
nH = 2nH2O = 2.0,14 = 0,28 mol
nO = 2nCnH2n-1COOH + 4nCmH2m(COOH)2 + nCkH2k+2O = 2x + 4y + z
=> mX = mC + mH + mO = 0,12.12 + 0,28.1 + 16(2x + 4y + z) = 32x + 64y + 16z + 1,72
* Phản ứng este hóa: Do sau phản ứng chỉ thu được chất có chứa chức este nên axit và ancol phản ứng vừa đủ
n ancol = x + 2y = z hay x + 2y – z = 0 (2)
BTKL ta có: mX = m este + mH2O => 32x + 64y + 16z + 1,72 = 3,22 + 18(x+2y)
hay 14x + 28y + 16z = 1,5 (3)
Từ (1) (2) (3) ta có hệ phương trình:
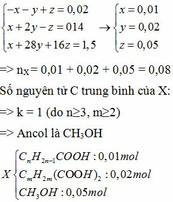
Bảo toàn nguyên tố C ta có: 0,01n + 0,02m + 0,05.1 = 0,12
=> n +2m = 7 mà do n≥3, m≥2 nên chỉ có cặp n = 3, m = 2 thỏa mãn
Vậy các axit trong X là: CH2=CH-COOH và HOOC-COOH.
Kết luận: Hỗn hợp X gồm các chất CH2=CH-COOH, HOOC-COOH và CH3OH.
- Một số ứng dụng của PVC trong thực tế như làm ống dẫn nước, vỏ dây điện, đồ giả da, áo mưa, nhãn chai nước khoáng, …
dtyyyyyyyyyyyyyyyyy