Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

a) Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C2H2 + 2Br2 —> C2H2Br4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH4 và CnH2n+2
Theo đề bài, VC2H2 tham gia phản ứng là : 0,896 – 0,448 = 0,448 (lít).
Vậy số mol C2H2 là 0,448\22,4=0,02(mol)
Gọi số mol của CH4 là X. Theo bài => số mol của CnH2n+2 cũng là x.
Vậy ta có : x+x=0,448\22,4=0,02⇒x=0,01
Phương trình hoá học của phản ứng.đốt cháy hỗn hợp :
2C2H2+5O2→4CO2+2H2O
0,02mol ---------------- 0,04mol
CH4+2O2→CO2+2H2O
0,01mol --------------0,02 mol
2CnH2n+2 + (3n+ 1) O2 —> 2nC02 + 2(n + 1)H20
0,01 mol --------------------------0,01 nmol
Vậy ta có :nCO2=0,04+0,01+0,01n=3,08\44⇒n=2
Công thức phân tử của hiđrocacbon X là C2H6.
b) Tính % thể tích các khí :
%VC2H2=0,448\0,896×100%=50%
%VCH4=%VC2H6=100%–50%\2=25%

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

n Br2=\(\dfrac{32}{160}\)=0,2 mol
C2H2+2Br2->C2H2Br4
0,1------0,2 mol
=>%VC2H2=\(\dfrac{0,1.22,4}{5,6}\).100=40%
=>%VCH4=100-40=60%
=>n CH4=\(\dfrac{5,6-0,1.22,4}{22,4}\)=0,15 mol
CH4+2O2-to>CO2+2H2O
0,15----0,3
C2H2+\(\dfrac{5}{2}\)O2-to>2CO2+H2O
0,1-----0,25 mol
=>VO2=(0,3+0,25).22,4=12,32l

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


\(n_{hhk}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
`->` Khí thoát ra là CH4
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,2 ( mol )
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,2 0,2 ( mol )
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
\(\%V_{CH_4}=\dfrac{0,2}{0,3}.100=66,67\%\)
\(\%V_{C_2H_4}=100-66,67=33,33\%\)

· Xét phản ứng của A với NaOH (CaO)
Số mol hidrocacbon = 0,05 mol
CxHyCOOH + NaOH → CxHyCOONa + H2O
CmHn(COOH)2 + 2NaOH → CmHn(COONa)2 + 2H2O
CxHyCOONa + NaOH →Na2CO3 + CxHy+1
CmHn(COONa)2 + 2NaOH →2Na2CO3 + CmHn+2
Vì chỉ thu được 1 hodrocacbon nên
=> x = m và y + 1 = n + 2
=> các axit trong A có chỉ số H bằng nhau
nA = nB = n hidrocacbon = 0,05mol
· Xét phản ứng đốt A:
nCO2 = 0,18 mol ; nH2O = 0,1 mol
=> số C trung bình = 0,18 : 0,05 = 3,6
Số H trung bình = 0,2 : 0,05 = 4
Vì 2 axit có chỉ số H bằng nhau nên
=> y + 1 = n + 2 = 4 => y = 3; n = 2
Mặt khác: m + 1 < 3,6 < m + 2
=> 1,6 < m < 2,6 => m = x = 2
CT của các axit: C2H3COOH → CTCT: CH2=CH–COOH
C2H2(COOH)2 → CTCT: HOOC–CH=CH–COOH ; CH2=C(COOH)2
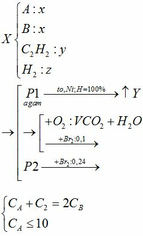
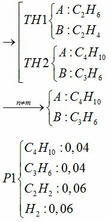
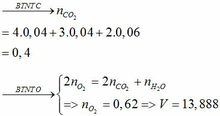
Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6