Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y<37.2
-> x+y< xấp xỉ 0.6(mol)
Mà theo đề bài,nH2SO4=1(mol)
->hỗn hợp tan hết,axit dư
Zn+H2SO4->ZnSO4+H2
Fe+H2SO4->FeSO4+H2
gọi nZn là x->nH2SO4(1)=x(mol)
nFe là y->nH2SO4(2)=y(mol)
nH2SO4=1(mol)
Ta có:65x+56y=37.2
=>65x+65y>37.2
-> x+y>xấp xỉ 0.6(mol)
56x+56y<37.2
->x+y<0.7
->0.6<x+y<0.7
mà nH2SO4 theo đề bài là 1mol
->hỗn hợp tan hết,axit dư ^^ xin lỗi bạn phần trước mình làm sai

a) PTHH: Zn + H2SO4 ===> ZnSO4 + H2
nZnSO4 = 483 / 161 = 3 (mol)
Theo phương trình, nH2 = nZnSO4 = 3 (mol)
=> VH2(đktc) = 3 x 22,4 = 67,2 lít
b) Theo phương trình, nZn = nZnSO4 = 3 (mol)
=> mZn = 3 x 65 = 195 (gam)
c) Theo phương trình, nH2SO4 = nZnSO4 = 3 (mol)
=> mH2SO4 = 3 x 98 = 294 (gam)

Câu 1:
a) - Điều chế O2:
.........2KClO3 --to--> 2KCl + 3O2
- Điều chế ZnO:
..........2Zn + O2 --to--> 2ZnO
- Điều chế H2, FeSO4:
..........Fe + H2SO4 (loãng) --> FeSO4 + H2
b) Pt: 2KClO3 --to--> 2KCl + 3O2
- Điều chế Al2O3:
..........4Al + 3O2 --to--> 2Al2O3
- Điều chế SO2:
...........S + O2 --to--> SO2
- Điều chế Fe3O4:
...........3Fe + 2O2 --to--> Fe3O4
c) - Điều chế H2:
............Zn + H2SO4 (loãng) --> ZnSO4 + H2
- Điều chế O2:
...........2KMnO4 --to--> K2MnO4 + MnO2 + O2
- Điều chế H2O:
...........2H2 + O2 --to--> 2H2O
- Điều chế H3PO4:
...........4P + 5O2 --to--> 2P2O5
...........P2O5 + 3H2O --> 2H3PO4
Câu 2:
nAlCl3 = \(\dfrac{26,7}{133,5}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + ....3H2
0,2 mol<----------- 0,2 mol-> 0,3 mol
mAl pứ = 0,2 . 27 = 5,4 (g)
VH2 = 0,3 . 22,4 = 6,72 (lít)
nH2O = \(\dfrac{9}{18}=0,5\) mol
Pt: .....2H2 + O2 --to--> 2H2O
...0,3 mol-------------> 0,3 mol
...CH4 + 2O2 --to--> CO2 + 2H2O
0,1 mol<--------------------(0,5 - 0,3) mol
VCH4 cần dùng = 0,1 . 22,4 = 2,24 (lít)

Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!

Do cả 3 kim loại đều tạo hợp chất hóa trị 2 nên ta đặt công thức chung cho oxit là MO, công thức chung cho muối là MCl2. Rõ ràng ta thấy là số nguyên 2 công thức chỉ khác nhau ở chỗ O và Cl2, tức là thế 1 O = 2 Cl sẽ thu được muối (số mol nguyên tử Cl hay Cl- = 2 lần số mol O).
Khối lượng Oxi thu vào để tạo Oxit là:
mO = 44,6 – 28,6 = 16 g
nO = 16/16 = 1 mol (ở đây tính số mol của nguyên tử Oxi chứ không phải phân tử O2)
\(\Rightarrow n_{Cl^-}\) = 2 mol
Khối lượng Cl- xem như bằng khối lượng Cl do khối lượng electron không đáng kể
\(\Rightarrow m_{Cl^-}\) = \(2.35,5\) = 71g
\(\Rightarrow\)Tổng khối lượng kim loại ban đầu sẽ tạo thành muối trong dung dịch (do tan hết trong axit)
\(\Rightarrow\)Tổng khối lượng muối = khối lượng kim loại + Khối lượng Cl-
= 28,6 + 71 = 99,6 g
ĐA= 99,6g
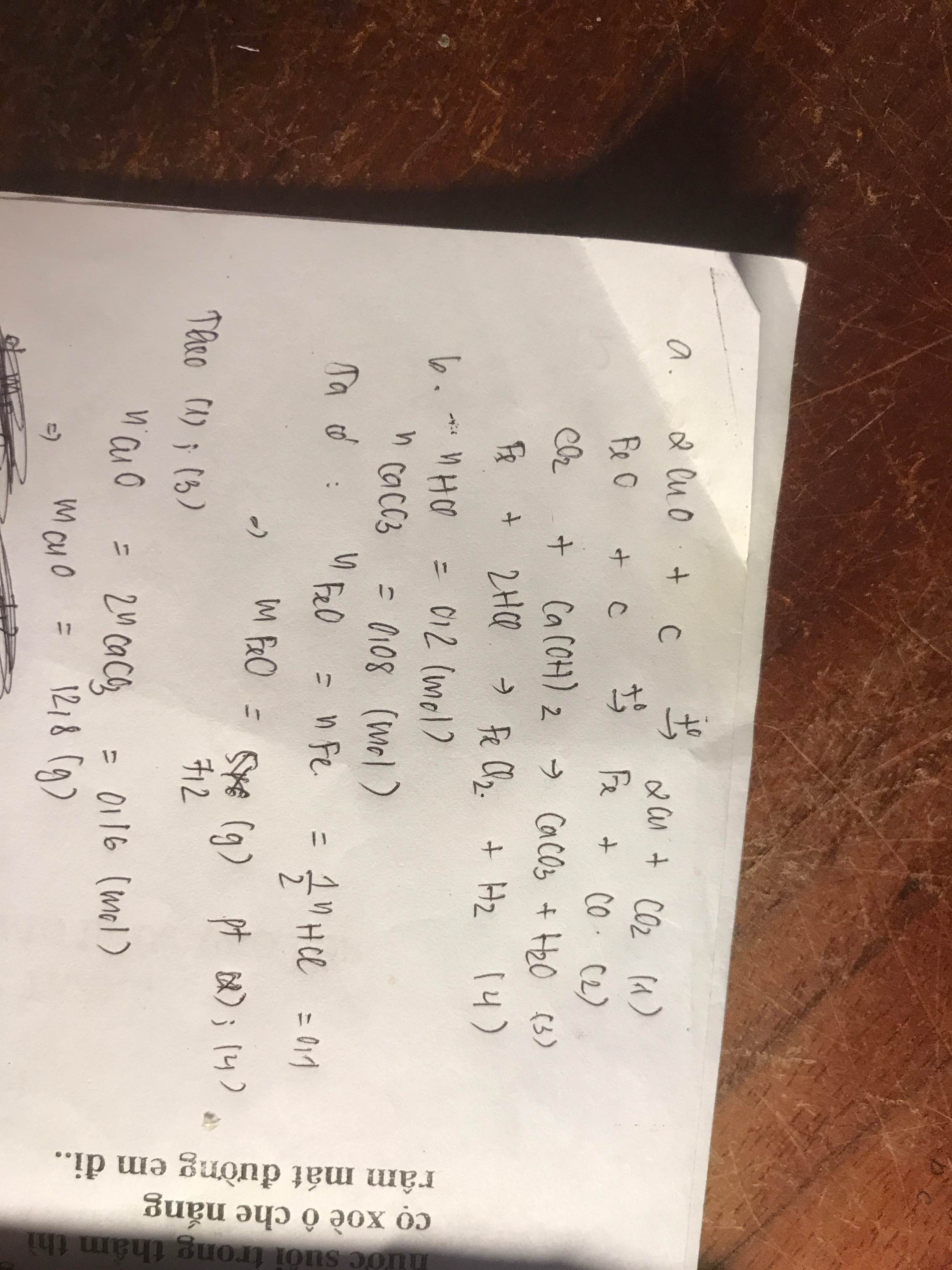

Gọi x,y,z là số mol của \(CuO, Al_2O_3, FeO\)
=> \(80x+102y+72z=6,1\)(1)
A + \(H_2SO_4\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
=>x+3y+z=0,13 (2)
B+NaOH dư, lấy kết tủa nung trong không khí
=>Chất rắn là CuO và Fe2O3 do kết tủa của nhôm tan hết trong NaOH dư
\(BTNT(Cu):\)\(n_{CuO}=x\left(mol\right)\)
\(BTNT\left(Fe\right):n_{Fe_2O_3}=\dfrac{1}{2}n_{FeO}=\dfrac{z}{2}\)
=> 80x+\(160.\dfrac{z}{2}\)=3,2 (3)
Từ (1), (2), (3)=>x=0,02 ; y=0,03; z=0,02
\(\Rightarrow m_{CuO}=1,6\left(g\right);m_{Al_2O_3}=3,06\left(g\right);m_{FeO}=1,44\left(g\right)\)