Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.15.................................0.15\)
\(n_{Fe}=1.25\cdot0.15=0.1875\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(0.1875..........................................0.28125\)
\(V_{SO_2}=6.3\left(l\right)\)

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
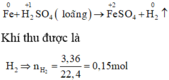
Các quá trình nhường, nhận electron :
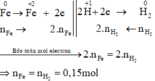
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
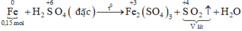
Các quá trình nhường, nhận electron:
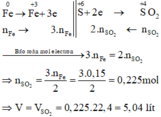

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Fe tan trong H2SO4 => phần ko tan trong H2SO4 loãng là R
nH2= \(\frac{4,48}{22,4}\)=0,2 mol
Fe + H2SO4 ----> FeSO4 +H2
0,2..........................................0,2
mR=17,6-56*0,2=6,4 (g)
gọi n là hóa trị của R; nSO2 =\(\frac{2,24}{22,4}\)=0,1 mol
2R +2nH2SO4 -----> R2(SO4)n + nSO2 +2nH2O
\(\frac{0,2}{n}\).....................................................0,1
=> MR = 6,4 : \(\frac{0,2}{n}\)=32n
biện luận
| n | 1 | 2 | 3 |
| R | 32 | 64 | 96 |
| kq | loại | Cu(nhận) | loại |
=> R là Cu
chọn D

nH2=0,6mol
PTHH: 2Al+6HCl=>2AlCl3+3H2
0,4<-1,2<--0,4 <- 0,6
=> mAl=0,4.27=10,8g
=> m AL2O3=21-10,8=10,2g
=> nAl2O3=0,1mol
PTHH: Al2O3+6HCl=> 2AlCl3+3H2O
0,1--->0,6------>0,2----->0,3
PTHH: AlCl3+3NaOH=> Al(OH)3+3NaCl
nAl(OH)3=0,4mol
nAlCl3=0,4+0,2=0,6mol
ta có : 0,6 : 0,4
=> n AlCl3 dư theo n nAl(OH)3
p/ư: 0,4<-1,2<------0,4--->1,2
=> V (NaOH) cần dùng là : V=1,2:0,5=2,4l

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

n O = 10.24%/16 = 0,15(mol)
Quy đổi X gồm n Fe = a(mol) ; n S = b(mol) ; n O = 0,15(mol)
=> 56a + 32b + 0,15.16 = 10(1)
n SO2 = 1,68/22,4 = 0,075(mol)
Bảo toàn electron :
3a + 6b = 0,15.2 + 0,075.2(2)
Từ (1)(2) suy ra a = 0,13 ; b = 0,01
Gọi n O2 = n O3 = x(mol)
Bảo toàn electron :
4n O2 + 6n O3 + 2n O = 3n Fe + 4n S
<=> 4x + 6x + 0,15.2 = 0,13.3 + 0,01.4
<=> x = 0,013
=> V = (0,013 + 0,013).22,4 = 0,5824 lít

ta có hpt : pt1 x+y=0,25 pt 2 64x+44y=28*2*0,25 giải x và y là số mol của CO2 và SO2
bảo toàn e giữa Fe và S ta có nFe=2nSO2 ---> nFe --> nFe2(SO4)3 =1/2nFe --> n gốcSO4 trong muối sau đó cộng mol trong muối và nSO2
cách tính nhanh nH2SO4 phản ứng =2nSO2
mk chưa tính chỉ nêu cách làm chỗ nào sai xót thì mk xin lỗi nha
chúc bạn học tốt
Chọn B