
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

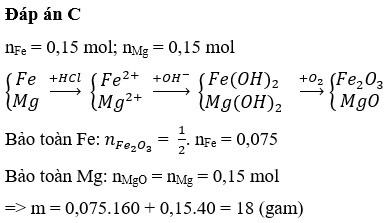

nO/X = (5,92 – 4,16) ÷ 16 = 0,11 mol
[O] + 2HCl → 2Cl + H2O ⇒ nCl– = 2nO = 0,22 mol.
Đặt nMg = x; nFe = y ⇒ 24x + 56y = 4,16(g).
Rắn gồm x mol MgO và 0,5y mol Fe2O3
⇒ 40x + 160.0,5y = 6(g)
⇒ giải hệ có: x = 0,01 mol; y = 0,07 mol.
Bảo toàn electron cả quá trình:
2nMg + 3nFe = 2nO + nAg ⇒ nAg = 2 × 0,01 + 3 × 0,07 - 2 × 0,11 = 0,01 mol.
► Kết tủa gồm 0,01 mol Ag và 0,22 mol AgCl
⇒ m = 0,01 × 108 + 0,22 × 143,5 = 32,65(g).
Đáp án C

Nhận thấy 9,2 gam oxit > 8,4 gam X → nên Ag+, Cu2+ phản ứng hết
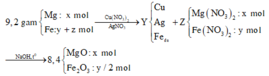
Gọi số mol Fe tham gia phản ứng là y mol, số mol Fe dư là x mol
→ nO2 pư để tạo thành Fe2O3 = y/4 mol
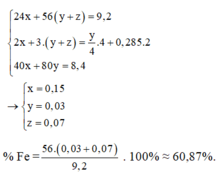
Đáp án A

Đáp án D
(Mg, Fe) + (AgNO3, Cu(NO3)2) => 3 kim loại
=> Chứng tỏ Mg, AgNO3, Cu(NO3)2 phản ứng hết, Fe còn dư; 3 kim loại là Ag, Cu, Fe.
Dung dịch Z chứa Mg(NO3)2 và Fe(NO3)2.
Đặt số mol Mg, Fe phản ứng, Fe dư lần lượt là a, b, c
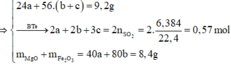
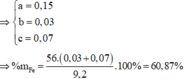

Đáp án D
Sơ đồ quá trình:
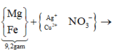
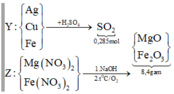
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
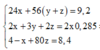
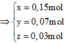
Theo đó, ![]()