Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

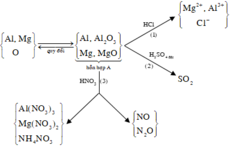
Gọi số mol của Cu là a => nAl= 2a, nMg= 3a
mCu+mAl+mMg = 19 => a=0,1 =>nCu=0,1(mol);nAl=0,2(mol);nMg=0,3(mol)
dY/H2 =18,5 => M(Y)= 37 (dùng pp đường chéo) => nNO=nN2O
n(Y)= \(\dfrac{4,48}{22,4}\) =0,2 (mol)
Suy ra: nNO=nN2O= 0,1 (mol)
nNH4NO3 =\(\dfrac{\text{0,1.2+0,2.3+0,3.2−0,1.3−0,1.8 }}{8}\)=0,0375 (mol) bảo toàn e nhe
mm′ = mCu(NO3)2+ mAl(NO3)3 +mMg(NO3)2+mNH4NO3 = 108,8(g) ( khúc này bảo toàn nguyên tố Cu,Al,Mg => số mol của muối Cu2+,Al3+,Mg2+ )

Đặt nN2O= x mol; nN2= y mol
Ta có nhhY= x+y= 1,792/ 22,4= 0,08 mol
mhhY=44x + 28y= 0,08.18.2
Giải hệ trên được x= 0,04 và y= 0,04
nAl= 0,27 mol= nAl(NO3)3
Quá trình cho e:
Al→ Al3++ 3e (1)
0,27→ 0,81 mol
Quá trình nhận e:
2NO3-+ 10e+ 12H+ → N2 + 6H2O (2)
0,4 ← 0,04 mol
2NO3-+ 8e+ 10H+ → N2O + 5H2O (3)
0,32 ← 0,04 mol
Tổng số mol e nhận ở (2) và (3) là ne nhận= 0,4+ 0,32= 0,72 mol <0,81 mol
Do đó còn xảy ra quá trình nhận e: ne nhận ở (4)= 0,81- 0,72= 0,09 mol
NO3-+ 8e+ 10H+ → NH4++ 3H2O (4)
0,09 → 0, 01125 mol
Dung dịch X chứa 0,27 mol Al(NO3)3 và 0,01125 mol NH4NO3
→m=0,27.213+ 0,01125.80=58,41 gam
Đáp án D
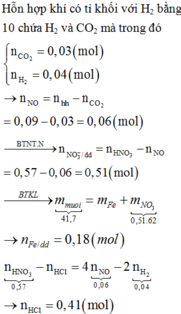
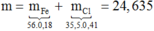

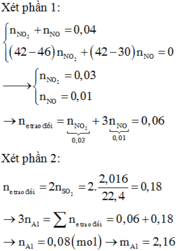
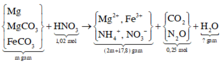
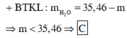

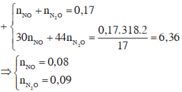

Ta có: \(n_A=0,3\left(mol\right);\overline{M_A}=22,6.2=45,2\)
2 khí chắc chắn phải có CO2 (M=44) => Khí còn lại là sản phẩm khử của N có M > 45,2
=>Khí đó phải là NO2
\(\Rightarrow\begin{cases}CO_2:a\left(mol\right)\\NO_2:b\left(mol\right)\end{cases}\)
\(\Leftrightarrow\begin{cases}a+b=0,3\\44a+46b=13,56\end{cases}\)
\(\Leftrightarrow\begin{cases}a=0,12\\n=0,18\end{cases}\)
\(\Rightarrow n_{FeCO_3}=n_{CO_2}=0,12\left(mol\right)\)
Khi tác dụng với HNO3.Bảo toàn electron,ta được:
\(n_{Fe_3O_4}+n_{FeCO_3}=n_{NO_2}\)
\(\Rightarrow n_{Fe_3O_4}=0,18-0,12=0,06\left(mol\right)\)
\(\Rightarrow m=0,06.232+0,12.116=27,84\left(gam\right)\)