
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn B
Cu2+:x
Cl-: y
Ở catot thoát ra khí => H2O bị đp
Catot:
Cu2+ +2e → Cu
x 2x
H2O +1e → 0,5H2 + OH-
y-2x 0,5y-x
Anot:
Cl- - 1e → 0,5Cl2
y y 0,5y
=> 0,5y = 4(y-2x) => x/y=3/8
=>%mCuSO4 = 160.3/(160.3+74,5.8) = 44,61%

Chọn C.
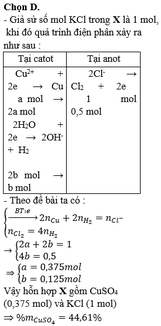
Giả sử số mol KCl trong X là 1 mol, khi đó quá trình điện phân xảy ra như sau:Theo đề bài ta có:
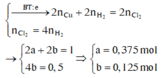
Vậy hỗn hợp X gồm CuSO4 (0,375 mol) và KCl (1 mol)
![]()

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

-\(n_{Fe}=\frac{11,2}{56}=0,2mol\) \(n_{Al}=\frac{m}{27}mol\) |
-khi thêm \(Fe\) vào cốc đựng \(HCl\) ( cốc A ) có phản ứng: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) 0,2 0,2 |
theo định luật bảo toàn khối lượng, khối lượng cốc \(HCl\) tăng thêm: \(11,2-\left(0,2.2\right)=10,8g\) |
khi thêm \(Al\) vào cốc đựng dd \(H_2SO_4\) có phản ứng: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) \(\frac{m}{27}mol\) \(\rightarrow\) \(\frac{3.m}{27.2}mol\) |
| khi cho \(m\) gam \(Al\) vào cốc B, cốc B tăng thêm : \(m-\frac{3.m}{27.2}mol\) |
để cân thăng bằng, khối lượng ở cốc đựng \(H_2SO_4\) cũng phải tăng thêm 10,8g.Có: \(m-\frac{3.m}{27.2}.2=10,8\)
|
| giải ra được \(m=\) \(\left(g\right)\) |