Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nZn = x mol; nFe = y mol.
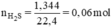
Ta có hệ phương trình: 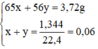
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

số mol hí thu được là:\(n_{H_2}=\frac{V_{H_2}}{22,4}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(X+H_2SO_4\rightarrow XSO_4+H_2\)
0,2 0,2 (mol)
\(M_X=\frac{m}{n}=\frac{13}{0,2}=65\left(đvC\right)\)
→kim loại hóa trị II có M=65 là kẽm (Zn)
X+H2SO4\(\rightarrow\) XSO4+H2
n của h2 =0,2 mol\(\Rightarrow\) n của X=0.2 \(\Rightarrow\) Mcủa X=13:0,2=....
tra bảng tuần hoàn là ra x

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

a)
\(n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{H_2SO_4} = \dfrac{80.19,6\%}{98} = 0,16(mol)\)
Gọi n là hóa trị của kim loại M
\(2M + nH_2SO_4 \to M_2(SO_4)_n + nH_2\)
Theo PTHH :
\(n_M = \dfrac{2}{n}n_{H_2} = \dfrac{0,3}{n}(mol)\\ n_{H_2SO_4\ phản\ ứng} = n_{H_2} = 0,15(mol)\\ \Rightarrow n_{H_2SO_4\ dư} = 0,16-0,15 = 0,01(mol)\)
Ta có : \(M = \dfrac{8,4}{\dfrac{0,3}{n}} = 28n\)
Với n = 2 thì M = 56(Fe)
b)
Sau phản ứng, mdung dịch = 8,4 + 80 - 0,15.2 = 88,1(gam)
\(n_{FeSO_4} = n_{H_2} = 0,15(mol)\)
Vậy :
\(C\%_{FeSO_4} = \dfrac{0,15.152}{88,1}.100\% = 25,88\%\\ C\%_{H_2SO_4} = \dfrac{0,01.98}{88,1}.100\% = 1,11\%\)

nFe = 11.2/56 = 0.2 (mol)
Fe + S -to-> FeS
0.2________0.2
FeS + H2SO4 => FeSO4 + H2S
0.2____________________0.2
VH2S = 0.2*22.4 = 4.48 (l)
\(Fe+S\underrightarrow{t^o}FeS\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(\Rightarrow V_{H_2S}=0,2.22,4=4,48l\)

a)Gọi A là kim loại cần tìm.
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
Ta có PTHH:
\(2A+2H_2O\rightarrow2AOH+H_2\uparrow\)
0,1-----------------0,1--------0,05-----(mol);
Vậy \(M_A=\dfrac{2,3}{0,1}=23\)(g/mol) => A là Na
b) Ta có: \(m_{dd}=2,3+57,8-0,05\cdot2=60g\)
Từ đó suy ra:\(\%C_{NaOH}=\dfrac{0,1\cdot40}{60}\cdot100\%=6,67\%\)
Có lẽ đề phải là 5,04 lít khí bạn nhỉ?
Gọi kim loại cần tìm là A.
Có: \(n_{H_2}=0,225\left(mol\right)\)
PT: \(2A+6HCl\rightarrow2ACl_3+3H_2\)
___0,15__________________0,225 (mol)
\(\Rightarrow M_A=\dfrac{4,05}{0,15}=27\left(g/mol\right)\)
Vậy: A là nhôm (Al).
Bạn tham khảo nhé!
Cho hỏi sao lại có phương trình 2A + 6HCl->2ACl3+3H2 vậy