Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_M=\dfrac{7}{M_M}\left(mol\right)\)
\(n_{SO_2}=0,1875\left(mol\right)\)
Giả sử: M có hóa trị cao nhất là a.
⇒ Số e cho là a.
Theo ĐLBT mol e, có: \(\dfrac{7a}{M_M}=0,1875.2\)
\(\Rightarrow M_M=\dfrac{56a}{3}\left(g/mol\right)\)
Với a = 1 ⇒ MM = 56/3 (loại)
a = 2 ⇒ MM = 112/3 (loại)
a = 3 ⇒ MM = 56 (nhận)
Vậy: M là Fe.
Bạn tham khảo nhé!

Ta có:
n H2 = 0,04 ( mol )
PTHH
5M +12 HNO3 ===>5 M(NO3)2 + N2 + 6H2O
0,2------------------------------------------0,04
theo pthh: n M = 0,2 ( mol )
=> M= 13 : 0,2 = 65 ( Zn )

Đáp án D.
nZn = 0,2 (mol),
Giả sử sản phẩm khử chỉ có N2.
Ta có: số mol e nhường = 0,4 < số mol e nhận = 0,2.
Vậy sản phẩm khử phải có NH4NO3.

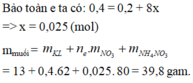

Kim loại M có hóa trị n (n= 1,2,3)
nN2O = 6,72/22,4 = 0,3 mol => ne nhận = 0,3.8 = 2,4 mol
Áp dụng định luật bảo toàn electron => ne kim loại M nhường = 2,4 mol
Quá trình oxi hóa Quá trình khử
M → M+n + ne 2N+5 + 8e → N+12
\(\dfrac{2,4}{n}\) <----- 2,4 2,4<---- 0,3
=> nM = 2,4/n và phân tử khối M = \(21,6:\dfrac{2,4}{n}\) = 9n
=> n =3 và MM = 27 , kim loại M là nhôm (Al)

10,8 g chất rắn đó là Ag không tan trong dd HCl
=> mMg + mAl = 23,7 - 10,8 = 12,9 (g)
nH2 = 14,56/22,4 = 0,65 (mol)
PTHH:
Mg + 2HCl -> MgCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Theo 2 PTHH trên: nHCl = 2nH2 = 2 . 0,65 = 1,3 (mol)
Áp dụng ĐLBTKL, ta có:
mAl + mMg + mHCl = m(muối) + mH2
=> m(muối) = 12,9 + 36,5 . 1,3 - 0,65 . 2 = 59,05 (g)

Đáp án B
Tính số mol các khí trong B:
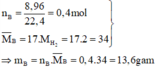
Đặt số mol các khí trong B là NO : a mol ; NO2 : b mol
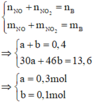
Số mol của M là: n M = 32 M m o l
Gọi n là hóa trị của M
Sơ đồ phản ứng:


Chọn C
n M g = 0 , 1 ( m o l )
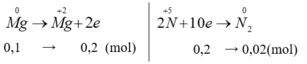
V N 2 = 0 , 02 . 22 , 4 = 0 , 448 ( l )

10M+ 12nHNO3-> 10M(NO3)N+ nN2+ 6nH2O
0,02/n*10 <- 0,448/22,4
=> 2,4/M= 0,2/n
=> 12n= M
thấy chỉ có n=2, M=24 thỏa mãn
=> M là mg