Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Mg} = a(mol) ; n_{Zn} = b(mol) \Rightarrow 24a + 65b = 15,3(1)$
$Mg + 2HCl \to MgCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra : $a = \dfrac{81}{410} ; b = \dfrac{21}{205}$
$m_{Mg} = \dfrac{81}{410}.24 = 4,74(gam)$
$m_{Zn} = 15,3 - 4,74 = 10,56(gam)$

a)
n O = 6,13.23,491%/16 = 0,09(mol)
=> n Al2O3 = 1/3 n O = 0,03(mol)
n H2 = 1,456/22,4 = 0,065(mol)
$H_2O \to OH^- + \dfrac{1}{2}H_2$
Suy ra: n OH = 2n H2 = 0,065.2 = 0,13(mol)
Al2O3 + 2OH- → 2AlO2- + H2O
0,03......0,06..........0,06.....................(mol)
DUng dịch G có :
AlO2- : 0,06
OH- : 0,13 - 0,06 = 0,07(mol)
Áp dụng CT :
n H+ = 4n AlO2- + n OH- - 3n Al(OH)3
<=> 0,16 = 0,06.4 + 0,07 - 3n Al(OH)3
<=> n Al(OH)3 = 0,05(mol)
<=> m = 0,05.78 = 3,9(gam)
Trong F :
m Na + m K + m Ba = m D - m Al2O3 = 6,13 - 0,03.102 = 3,07(gam)
n Cl = n HCl = 0,16(mol)
n Al3+ = 0,06 - 0,05 = 0,01(mol)
=> m chất tan = 3,07 + 0,16.35,5 + 0,01.27 = 9,02(gam)

Câu 1:
PTHH: \(Na+\dfrac{1}{2}Cl_2\xrightarrow[]{t^o}NaCl\)
Ta có: \(n_{NaCl}=2n_{Cl_2}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\)
Câu 2:
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\) \(\Rightarrow m_{H_2}=0,04\cdot2=0,08\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\) \(\Rightarrow m_{HCl}=0,08\cdot36,5=2,92\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=4,29\left(g\right)\)

\(Đặt:\)
\(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
\(m_{hh}=24x+56y=13.6\left(g\right)\\ n_{H_2}=x+y=0.3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0.1\\y=0.2\end{matrix}\right.\)
\(\%Mg=\dfrac{0.1\cdot24}{13.6}\cdot100\%=17.64\%\\ \%Fe=100-17.64=82.36\%\)
\(n_{HCl}=2n_{H_2}=2\cdot0.3=0.6\left(mol\right)\)
\(V_{HCl}=\dfrac{0.6}{2}=0.3\left(l\right)\)
\(m_Y=m_{MgCl_2}+m_{FeCl_2}=0.1\cdot95+0.2\cdot127=34.9\left(g\right)\)

\(n_{H_2SO_4}=0,5.0,2=0,1\left(mol\right)\\ n_{HCl}=0,2.2,5=0,5\left(mol\right)\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{H^+}=2n_{H_2SO_4}+n_{HCl}=0,7\left(mol\right)\)
Giả sử kim loại dư
\(\Rightarrow n_{H_2}=\dfrac{1}{2}\Sigma n_{H^+}=\dfrac{1}{2}.0,7=0,35\left(mol\right)>0,25\left(mol\right)\)
Vậy kim loại hết
Đặt \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow24x+27y=5,1\left(g\right)\) (I)
BT e:
cho:
\(Mg^o\rightarrow Mg^{2+}+2e\)
x------------------>2x
\(Al^o\rightarrow Al^{3+}+3e\)
y--------------->3y
nhận:
\(2H^++2e\rightarrow H_2O\)
0,5<--0,25
Từ trên có: \(2x+3y=0,5\left(II\right)\)
Từ (I), (II) giải được \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(CM_{H^+.dư}=\dfrac{0,7-0,5}{0,2}=1M\)
\(CM_{Mg^{2+}}=CM_{Al^{3+}}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{SO_4^{2-}}=0,5M\\ CM_{Cl^-}=2,5M\)

Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
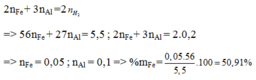
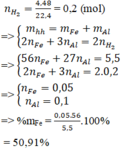


\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 2x x
PTHH: 2K + 2H2O → 2KOH + H2
Mol: 2y y
Ta có: \(\left\{{}\begin{matrix}2x+2y=16,3\\x+y=0,25\end{matrix}\right.\)
⇒ không giải đc (đề sai)