Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\Rightarrow n_{OH^-}=n_{H^+}=2.0,12=0,24\left(mol\right)\)
Để trung hoà ddX thì cần 0,24 mol H+ có trong ddY.
\(Đặt:n_{H_2SO_4}=a\left(mol\right)\Rightarrow n_{HCl}=2.2a=4a\left(mol\right)\) (Này viết PTHH ra em sẽ hiểu)
\(n_{H^+\left(trongY\right)}=2.n_{H_2SO_4}+n_{HCl}=2a+4a=6a\\ \Leftrightarrow0,24=6a\\ \Leftrightarrow a=0,04\\ \Rightarrow hhY:\left\{{}\begin{matrix}0,04\left(mol\right)H_2SO_4\\0,16\left(mol\right)HCl\end{matrix}\right.\\ \Rightarrow m_{muối}=m_{hh.kloai}+96.0,04+35,5.0,16=8,94+9,52=18,46\left(g\right)\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(n_{HCl}=0,5.0,2=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
Theo PT: \(n_{HCl\left(pư\right)}=2n_{H_2}=0,08\left(mol\right)< 0,1\left(mol\right)\)
→ HCl dư.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=x+y=0,04\left(1\right)\)
\(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=x\left(mol\right)\\n_{FeCl_2}=n_{Fe}=y\left(mol\right)\end{matrix}\right.\)⇒ 136x + 127y = 5,26 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,02\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,02.65}{0,02.65+0,02.56}.100\%\approx53,72\%\\\%m_{Fe}\approx46,28\%\end{matrix}\right.\)

Xin lỗi mấy bạn nha mình ghi lộn A B là hai kim loại có cùng hóa trị II

nH2 = 1 mol => nH+ cần trung hòa = 2nH2 = 2 mol
Gọi nH2SO4 = 3a mol => nHCl = a mol
=> nH+ = 3a.2 + a = 2 => a = \(\dfrac{2}{7}\)
=> nSO4= nH2SO4= 3.\(\dfrac{2}{7}\) = \(\dfrac{6}{7}\)mol; nCl = nHCl= \(\dfrac{2}{7}\) mol
Ta có
mmuối = mKim loại + mCl + mSO4
= 35 + \(\dfrac{2}{7}\).35,5 + \(\dfrac{6}{7}\).96 = 127,42 gam
Tham khảo :
nH2 = 1 mol => nH+ cần trung hòa = 2nH2 = 2 mol
Gọi nHCl = 3a mol => nH2SO4 = a mol
=> nH+ = 3a + 2a = 2 => a = 0,4
=> nCl = nHCl = 3.0,4 = 1,2 mol; nSO4 = nH2SO4 = 0,4 mol
Ta có mmuối = mKim loại + mCl + mSO4 = 35 + 1,2.35,5 + 0,4.96 = 116 gam

\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ Zn+2HCl->ZnCl_2+H_2\\ 2Al+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2\\ Fe+H_2SO_4->FeSO_4+H_2\\ Zn+H_2SO_4->ZnSO_4+H_2\\ n_{Al}=n_{Fe}=a\left(mol\right);n_{Zn}=3a\left(mol\right)\\ m_X=27,8=a\left(27+56\right)+3a.65\\ a=0,1\\ n_{HCl}=0,375.0,8=0,3mol\\ n_{H_2SO_4}=0,45mol\\ n_{H^{^+}}=0,3+0,9=1,2mol\\ BT.e^{^{ }-}:3n_{Al}+2n_{Fe}+2n_{Zn}=3a+2a+6a=1,1mol\\ 2n_{H_2}=4n_{H^{^+}}=4,8mol\\ 1,1< 4,8\Rightarrow X:pư.hết\\ 2n_{H_2}=1,1\Rightarrow n_{H_2}=0,55mol\\ V_{H_2}=0,55.22,4=12,32L\)

\(n_{H_2}=a\left(mol\right)\)
\(\text{Coi hỗn hợp là : kim loại M}\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(\text{Từ PTHH ta thấy : }\)
\(n_{HCl}=2n_{H_2}=2a\left(mol\right)\)
\(\text{Bảo toàn khối lượng : }\)
\(m_{hh}+m_{HCl}=m_{Muối}+m_{H_2}\)
\(\Leftrightarrow5+36.5\cdot2a=5.71+2a\)
\(\Leftrightarrow a=0.01\)
\(V_{H_2}=0.01\cdot22.4=0.224\left(l\right)\)
\(b.\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(FeO+H_2\underrightarrow{^{^{t^0}}}Fe+H_2O\)
\(n_{H_2O}=n_{H_2}=0.01\left(mol\right)\)
\(\text{Bảo toàn khối lượng : }\)
\(m_{hh}=m_{kl}+m_{H_2O}-m_{H_2}=0.6+0.01\cdot18-0.01\cdot2=0.76\left(g\right)\)

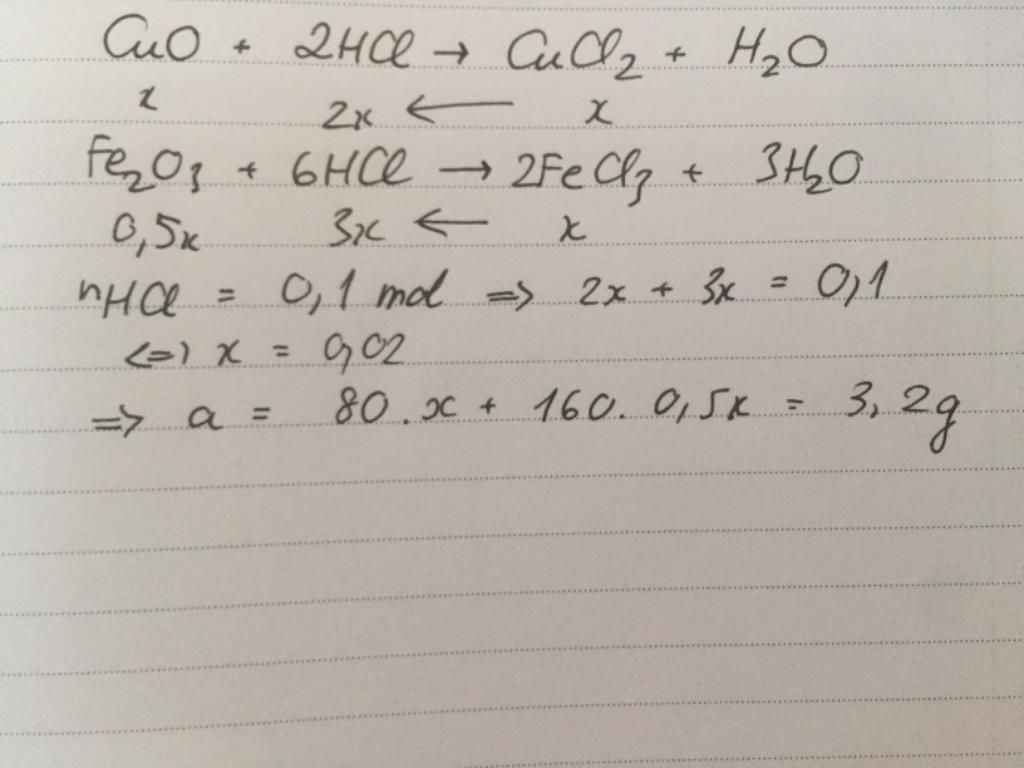
a) Gọi \(\left\{{}\begin{matrix}n_{Fe_2O_3}=a\left(mol\right)\\n_{CuO}=b\left(mol\right)\end{matrix}\right.\left(ĐK:a,b>0\right)\)
=> 160a + 80b = 4 (1); \(n_{HCl}=0,13.1=0,13\left(mol\right)\)
PTHH: Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
a-------->6a-------->2a
CuO + 2HCl ---> CuCl2 + H2O
b------>2b-------->b
b) nHCl = 6a + 2b = 0,13 (2)
Từ (1), (2) => a = 0,015; b = 0,02
=> \(\dfrac{n_{FeCl_3}}{n_{CuCl_2}}=\dfrac{2.0,015}{0,02}=\dfrac{3}{2}\)