Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Na là kim loại kiềm tác dụng với nước và không khí ở nhiệt độ thường nhưng không tác dụng với dung môi hữu cơ như dầu hỏa , vì vậy muốn bảo quản Na ta ngâm vào dầu hỏa để tránh cho Na tiếp súc với không khí bên ngoài

Giống như các kim loại kiềm khác, natri là một kim loại mềm, nhẹ, màu trắng bạc, là nguyên tố có phản ứng hóa học mạnh nên không thể tìm thấy ở dạng tự do trong thiên nhiên.
Natri nổi trong nước và có phản ứng mãnh liệt với nước, tạo ra hiđrô và các ion hiđrôxít. Nếu được chế thành dạng bột đủ mịn, natri sẽ tự bốc cháy trong nước.
Tuy nhiên, nó thông thường không bốc cháy trong không khí có nhiệt độ dưới 388 K (khoảng 115°C).
Dạng bột của natri là chất nổ mạnh trong nước và là chất độc có khả năng liên kết và rời liên kết với nhiều nguyên tố khác.
Làm việc hay tiếp xúc với natri phải cực kỳ cẩn thận trong mọi lúc, mọi nơi. Natri phải được bảo quản trong khí trơ hay dưới các lớp dầu mỏ
Vì vậy nên trong phòng thí nghiệm người ta thường ngâm Na trong dầu.
Trong không khí chứa hơi ẩm (H2O) và khí O2. Mà Na lại tác dụng với H2O và O2. Nên phải ngâm Na trong dầu hoả để không cho hơi nước, khí oxi tác dụng với Na.
PTHH: 2Na + 2H2O --> 2NaOH + H2
4Na + O2 ---> 2Na2O

cho tác dụng với nước
ko tan => MgO
tan => SO3 , Na2O , CaO
nhúng QT vào 3 lọ
hóa đỏ => H2SO4 => SO3
hóa xanh => NaOH , Ca(OH)2 => Na2O , CaO
SO3 + H2O -> H2SO4
Na2O + H2O-> 2NaOH
CaO + H2O -> CA(OH)2
sục từ từ vào CO2
dd xuất hiện vẩn đục => Ca(OH)2 => CaO
dd ko có ht => NaOH => Na2O
CO2 + Ca(OH)2 ----> CaCO3 (kt trắng) + H2O
CO2 + 2NaOH ---> Na2CO3 + H2O

$2Na+2H_2O\to 2NaoH+H_2$
$CaO+H_2O\to Ca(OH)_2$
$P_2O_5+3H_2O\to 2H_3PO_4$
$SO_3+H_2O\to H_2SO_4$
$Na_2O+H_2O\to 2NaOH$
`2Na + 2H_2O -> 2Na_2O + H_2` `\uparrow`
`CaO + H_2O -> Ca(OH)_2`
`SO_3 + H_2O -> H_2SO_3`
`Na_2O + H_2O -> 2Na(OH)`
`P_2O_5 + H_2O -> 2H_3PO_4`.

a, Muối kali pemanganat có màu tím
b, $Cu+O_2\rightarrow CuO$ (Kim loại chuyển từ màu đỏ thành màu đen)
$Fe_3O_4+H_2\rightarrow Fe+H_2O$ (Oxit màu đen nóng đỏ chuyển dần thành chất rắn màu xám có ánh kim)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 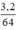 = 0,05 mol
= 0,05 mol
nFe = 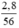 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 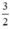 . nFe =
. nFe = 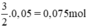 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

a) Ví dụ: 2 Na + 1/2 O2 → Na2O (kim loại Na oxi hóa tạo thành oxit bazơ Na2O)
b) Ví dụ: S + 3 O2 → SO3 (phi kim S oxi hóa tạo thành oxit axit SO3)
c) Ví dụ: 4 Fe + 3 O2 → 2 Fe2O3 (hợp chất Fe oxi hóa tạo thành oxit bazơ Fe2O3)
d) Ví dụ: Mg + 2 HCl → MgCl2 + H2 (kim loại Mg tác dụng với axit HCl để điều chế khí hiđro H2)
e) Ví dụ: CaO + H2O → Ca(OH)2 (oxit bazơ CaO tác dụng với nước H2O tạo thành bazơ Ca(OH)2)
f) Ví dụ: SO3 + H2O → H2SO4 (oxit axit SO3 tác dụng với nước H2O tạo thành axit H2SO4)
g) Ví dụ: 2 Na + 2 H2O → 2 NaOH + H2 (kim loại Na tác dụng với nước H2O tạo thành bazơ NaOH và khí hiđro H2)
h) Ví dụ: CuO + CO → Cu + CO2 (cacbon(II)oxit CO khử oxi hóa oxit bazơ CuO tạo thành kim loại Cu và oxit khí CO2)