Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt công thức oxit sắt là FexOy có số mol là a mol
Ta có: nCO= 0,2 mol
FexOy+ yCO → t 0 xFe + yCO2
a ay ax ay mol
Sau phản ứng thu được ay mol CO2, (0,2-ay) mol CO dư
M ¯ = m h h n h h = 44 . a y + 28 . ( 0 , 2 - a y ) a y + 0 , 2 - a y = 40 → a y = 0 , 15 m o l T a c ó : m F e x O y = a ( 56 x + 16 y ) = 56 a x + 16 a y = 8 g a m → a x = 0 , 1 m o l → x y = a x a y = 0 , 1 0 , 15 = 2 3 → C ô n g t h ứ c o x i t l à F e 2 O 3
Sau phản ứng thu được 0,15 mol C O 2 và 0,05 mol CO dư
→ % V C O 2 = 0 , 15 0 , 2 . 100 % = 75 %

Đáp án A.
→ n X = 0 , 5 ; n C O 2 = 0 , 15 ; n C O = 0 , 1 → n N 2 = 0 , 25
→
n
X
=
0
,
25
→
n
C
a
C
O
3
=
n
C
O
+
n
C
O
2
=
0
,
125
→
m
=
12
,
5

Đáp án A.
![]()
![]()
→ n X = 0 , 25 → n C a C O 3 = n C O + n C O 2 = 0 , 125 → m = 12 , 5

Đáp án A
Vì khi cho chất rắn thu được sau phản ứng với CO tác dụng với dung dịch HCl tạo ra khí H2 nên R phải là kim loại đứng sau Al và đứng trước hidro trong dãy hoạt động hóa học. Đặt công thức oxit của R là RxOy.
CuO + CO → Cu + CO2
a a
RxOy + y CO → x R + y CO2
c xc
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
b 6b
R + n HCl → RCln + n/2 H2
xc nxc xc nxc/2
Đặt số mol của CuO, Al2O3, RxOy trong 6,1 gam hỗn hợp A lần lượt là a, b và c. Ta có:
80 a + 102 b + ( x M R + 16 y ) c = 6 , 1 ( 1 ) 1 , 28 + 102 b + M R x c = 4 , 28 ( 2 ) 64 a = 1 , 28 ( 3 ) 6 b + n x c = 0 , 15 ( 4 ) n x c / 2 = 0 , 045 ( 5 ) ( 3 ) ⇒ a = 0 , 02 ( 5 ) ⇒ n c x = 0 , 09 ( 6 ) ( 4 ) ⇒ b = 0 , 01 ( 2 ) ⇒ M R = 28 n ⇒ n = 2 ; M R = 56 , R l à F e ( 6 ) ⇒ x c = 0 , 045 ( 1 ) ⇒ y c = 0 , 06 ⇒ x y = 0 , 045 0 , 06 = 3 4 ⇒ x = 3 ; y = 4
Công thức oxit là Fe3O4.

1. Phương trình hoá học của các phản ứng :
2 N H 3 + 3CuO → t ° N 2 + 3Cu + 3 H 2 O (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
CuO + 2HCl → C u C l 2 + H 2 O (2)
2. Số mol HCl phản ứng với CuO : n H C l = 0,02.1 = 0,02 (mol).
Theo (2), số mol CuO dư : n C u O = n H C l / 2 = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu - số mol CuO dư = 0,03 (mol).
Theo (1) n N H 3 = 2 n C u O /3 = 0,02 (mol) và nN2 = n C u O /3 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01. 22,4 = 0,224 (lít) hay 224 ml.

Dẫn khí CO chứ không phải CO2 em nhé
CO + CuO --> Cu + CO2 (1)
hỗn hợp khí thu được gồm \(\left\{{}\begin{matrix}CO_2\\CO_{dư}\end{matrix}\right.\). Cho hỗn hợp khí hấp thụ vào dung dịch Ba(OH)2 thì CO2 sẽ phản ứng
CO2 + Ba(OH)2 --> BaCO3↓ + H2O
nBaCO3 = 59,1/197 = 0,3 mol => nCO2 = 0,3 mol
Theo pư (1) ta thấy nCuO = nCO2 => mCuO = 0,3.80 = 24 gam

Dễ thấy Y gồm CO2 và CO dư với số mol là x và y ⇒ nCO2 = n↓ = 0,075 mol.
► MY = 40. Dùng sơ đồ đường chéo: nCO dư : nCO2 = 1 : 3 ⇒ nCO dư = 0,025 mol.
⇒ nCO ban đầu = 0,025 + 0,075 = 0,1 mol ⇒ nSO2 = 0,1 × 0,75 = 0,075 mol. Lại có:
2H2SO4 + 2e → SO2 + SO42– + 2H2O || [O] + H2SO4 → SO4 + H2O.
⇒ nO/X = 0,21 – 0,075 × 2 = 0,06 mol ⇒ mKL/X = 6 - 0,06 × 16 = 5,04(g).
● Giả sử hóa trị cao nhất của kim loại là n. Bảo toàn electron:
nKL = (0,075 × 2 + 0,06 × 2) ÷ n = 0,27 ÷ n ⇒ M = 5,04 ÷ (0,27 ÷ n) = 56n ÷ 3.
⇒ n = 3 và M = 56 (Fe) ⇒ nFe = 0,09 mol. ∑nO/oxit ban đầu = 0,06 + 0,075 = 0,135 mol.
⇒ Fe : O = 0,09 ÷ 0,135 = 2 : 3 ⇒ Fe2O3 ⇒ ∑số nguyên tử = 5 ⇒ chọn A.
Đáp án A
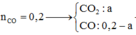
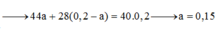
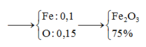

CO+ CuO---->Cu+CO2
CO2+CuO--->CuCO3
CuO+ H2SO4---->CuSO4+H2O
m\(_{H2SO4}=\)60.1,8=108(g)
m\(_{H2SO4}=\frac{108.85}{100}=91,8\left(g\right)\)
m\(_{H2SO4}tg\) phản ứng=\(\frac{91,8.42,7}{100}=39,2\left(g\right)\)
n\(_{H2SO4}=\frac{39,2}{98}=0,4\left(mol\right)\)
Theo pthh2
n\(_{CuO}=n_{H2SO4}=0,4\left(mol\right)\)
Theo bài
n\(_{CuO}=\frac{20}{80}=0,25\left(mol\right)\)
Đến đây làm sao nx thầy Cù Văn Thái
CuO k phản ứng với CO2 nhé Duong Le