
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: Al2O3+6HCl➝2AlCl3+3H2O(1)
a)nAl2O3=\(\dfrac{10,2}{102}\)=0,1(mol)
mHCl=\(\dfrac{5\%.219}{100\%}\)=10,95(g)
⇒nHCl=\(\dfrac{10,95}{36,5}\)=0,3(mol)
Xét tỉ lệ Al2O3:\(\dfrac{0,1}{1}\)=0,1
Xét tỉ lệ HCl:\(\dfrac{0,3}{6}\)=0,05
⇒HCl pứng hết,Al2O3 còn dư
Theo PTHH(1) ta có nAl2O3 pứng=\(\dfrac{nHCl}{6}\)=\(\dfrac{0,3}{6}\)=0,05(mol)
⇒nAl2O3 dư=nAl2O3ban đầu-nAl2O3 pứng=0,1-0,05=0,05(mol)
⇒mAl2O3 dư=0,05.102=5,1(g)
b) C%HCl=\(\dfrac{0,3.36,5}{219+10,2}\).100%=4,8%
nAlCl3=0,1(mol)
⇒C%AlCl3=\(\dfrac{0,1.136,5}{10,2+219}\).100%=6%


1.
\(n_{KNO_3}=0.15\cdot0.1=0.015\left(mol\right)\)
\(m_{KNO_3}=0.015\cdot101=1.515\left(g\right)\)
2.
\(m_{KOH}=200\cdot20\%=40\left(g\right)\)
Sau khi pha :
\(m_{dd_{KOH}}=\dfrac{40}{16\%}=250\left(g\right)\)
\(m_{H_2O\left(tv\right)}=250-200=50\left(g\right)\)
3.
\(n_{NaOH}=2\cdot1=2\left(mol\right)\)
Sau khi pha :
\(V_{dd_{NaOH}}=\dfrac{2}{0.1}=20\left(l\right)\)
\(V_{H_2o\left(tv\right)}=20-2=18\left(l\right)\)
3)
$n_{KNO_3} = 0,15.0,1 = 0,015(mol)$
$m_{KNO_3} = 0,015.101 = 1,515(gam)$
4)
$m_{KOH} = 200.20\% = 40(gam)$
$m_{dd\ KOH\ 16\%} = \dfrac{40}{16\%} = 250(gam)$
$\Rightarrow m_{H_2O} = 250 -200= 50(gam)$
5)
$n_{NaOH} = 2.1 = 2(mol)$
$V_{dd\ NaOH} = \dfrac{2}{0,1} = 20(lít)$
$\Rightarrow V_{H_2O} = 20 - 2 = 18(lít)$
4)



PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(\left\{{}\begin{matrix}m_{H_2SO_4}=588\cdot5\%=29,4\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\) \(\Rightarrow\) Al2O3 còn dư
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)=n_{Al_2O_3\left(dư\right)}\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1\cdot342}{20,4+588-0,1\cdot102}\cdot100\%\approx5,72\%\)

nNa2SO4= 9,94/142=0,07(mol);
mBa(OH)2= 20,52(g) -> nBa(OH)2=0,12(mol)
PTHH: Na2SO4 + Ba(OH)2 -> BaSO4 + 2 NaOH
Ta cps: 0,07/1 < 0,12/1
=> Ba(OH)2 dư, Na2SO4 hết, tính theo nNa2SO4.
-> nBaSO4=nNa2SO4= 0,07(mol)
=> m(kết tủa)=mBaSO4=0,07.233=16,31(g)
=>m=16,31(g)
b) Dung dịch A thu được bao gồm NaOH và Ba(OH)2 dư.
nNaOH=2.0,07=0,14(mol) => mNaOH= 0,14.40=5,6(g)
nBa(OH)2 (dư)=0,12-0,07=0,05(mol)
=> mBa(OH)2 (dư)= 0,05.171=8,55(g)
=> mddA=Na2SO4 + mddBa(OH)2 - mBaSO4 = 9,94+ 100 - 16,31= 93,63(g)
=> C%ddBa(OH)2 (dư)= (8,55/93,63).100=9,132%
C%ddNaOH= (5,6/93,63).100=5,981%

6
Gọi x , y lần lượt là số mol của Al và Fe
\(n_{H_2}\)\(=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2 \)
x \(\rightarrow\) \(\dfrac{3}{2}x\) (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
y \(\rightarrow\) y (mol)
Từ trên ta có hpt
\(\left\{{}\begin{matrix}27x+56y=11\\\dfrac{3}{2}x+y=0.4\end{matrix}\right.\)
giải ra ta được
x=0.2-) mAl=0.2*27=5.4(g) =))\(\%Al=\dfrac{5.4}{11}\cdot100=49.1\%\)
y=0.1-)mFe=0.1*56=5.6(g) =))\(\%Fe=\dfrac{5.6}{11}\cdot100=50.9\%\)
5
Cu không pư được H2SO4 nên 6.4(g) chất rắn còn lại sau pư là Cu
\(m_{Fe}=10-6.4=3.6\left(g\right)\)
pthh:
\(Fe+H_2So_4\Rightarrow FeSo_4+H_2\)
\(\left\{{}\begin{matrix}\%Cu=\dfrac{0.1\cdot64}{10}\cdot100=64\%\\^{\%Fe=\dfrac{3.6}{10}\cdot100=36\%}\end{matrix}\right.\)









 giúp mình với ạ , mình đang cần gấp ạ, các bạn làm theo cách kẻ bảng ra giúp mình được không ạ
giúp mình với ạ , mình đang cần gấp ạ, các bạn làm theo cách kẻ bảng ra giúp mình được không ạ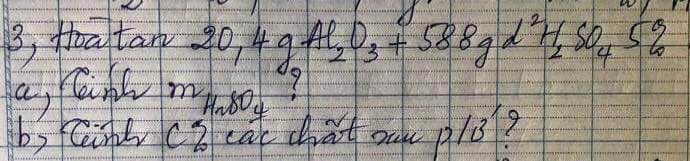


Bài 4:
a)
- Hòa tan 3 chất rắn vào dd NaOH
+ Chất rắn tan, sủi bọt khí: Al
2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
+ Chất rắn không tan: Fe, Cu
- Hòa tan 2 chất rắn còn lại vào dd HCl
+ Chất rắn tan, sủi bọt khí: Fe
Fe+ 2HCl --> FeCl2 + H2
+ Chất rắn không tan: Cu
b)
- Hòa tan 4 chất rắn vào nước:
+ Chất rắn tan: CaO
CaO + H2O --> Ca(OH)2
+ Chất rắn không tan: CuO, MgO, Al2O3
- Hòa tan 3 chất rắn còn lại vào dd NaOH
+ Chất rắn tan: Al2O3
Al2O3 + 2NaOH --> 2NaAlO2 + H2O
+ Chất rắn không tan: CuO, MgO
- Hòa tan 2 chất rắn còn lại vào dd HCl:
+ Chất rắn tan, tạo dd màu xanh: CuO
CuO + 2HCl --> CuCl2 + H2O
+ Chất rắn tan, tạo dd trong suốt: MgO
MgO + 2HCl --> MgCl2 + H2O
c)
- Cho 3 dd tác dụng với dd NaOH dư
+ Xuất hiện kết tủa trắng, sau đó tan: AlCl3
AlCl3 + 3NaOH --> Al(OH)3 + 3NaCl
NaOH + Al(OH)3 --> NaAlO2 + 2H2O
+ Xuất hiện kết tủa trắng, không tan: MgCl2
MgCl2 + 2NaOH --> Mg(OH)2 + 2NaCl
+ Xuất hiện kết tủa nâu đỏ: FeCl3
d)
- Cho quỳ tím tác dụng với 4 dd
+ QT chuyển xanh: NaOH, Na2CO3 (1)
+ QT không chuyển màu: Na2SO4, NaNO3 (2)
- Cho dd BaCl2 tác dụng với 2 dd ở (1)
+ Kết tủa trắng: Na2CO3
Na2CO3 + BaCl2 --> BaCO3 + 2NaCl
+ Không hiện tượng: NaOH
- Cho dd BaCl2 tác dụng với 2 dd ở (2)
+ Kết tủa trắng: Na2SO4
Na2SO4 + BaCl2 --> BaSO4 + 2NaCl
+ Không hiện tượng: NaNO3
Bài 5
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
_____0,3<--------------------------0,3
=> mMg = 0,3.24 = 7,2 (g)
Gọi số mol Cu, Ag là a, b
=> 64a + 108b = 29,8-7,2 = 22,6(g)
PTHH: 2Mg + O2 --to--> 2MgO
_____0,3------------------>0,3
2Cu + O2 --to--> 2CuO
a------------------>a
=> 0,3.40 + 80a + 108b = 36,2
=> a = 0,1; b = 0,15
=> mCu = 0,1.64 = 6,4 (g)
=> mAg = 0,15.108 = 16,2 (g)