
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{CuO}=\dfrac{30}{80}=0,375\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,375}{1}>\dfrac{0,3}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,3\left(mol\right)\Rightarrow m_{Cu}=0,3.64=19,2\left(g\right)\)

MFe2O3=56×2+16×3=160(g/mol)MFe2O3=56×2+16×3=160(g/mol)
%mFe=56×2160.100%=70%%mFe=56×2160.100%=70%
MFe3O4=56×3+16×4=232(g/mol)MFe3O4=56×3+16×4=232(g/mol)
%mFe=56×3232.100%≈72,4%

\(m_{NaCl}=\dfrac{150.10}{100}=15\left(g\right)\\ m_{H_2O}=150-15=135\left(g\right)\)
Đong 15 gam NaCl khan, 135 gam nước cho sẵn vào cốc nước. Sau đó hóa tan 15 gam NaCl vào nước, dùng đũa thủy tinh khuấy đều thu được dd như theo yêu cầu của đề bài

Câu 6 :
Trích mẫu thử
Đốt cháy các mẫu thử
- mẫu thử nào cháy với ngọn lửa xanh nhạt là H2
Cho tàn đóm vào hai mẫu thử còn :
- mẫu thử nào làm tàn đóm bùng lửa là oxi
- mẫu thử không hiện tượng gì là không khí

1
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,1 0,1 0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\\
m_{FeSO_4}=127.0,1=12,7\left(g\right)\)
\(m_{\text{dd}}=5,6+500-\left(0,1.2\right)=505,4\left(g\right)\\
C\%_{FeSO_4}=\dfrac{12,7}{505,4}.100\%=2,513\%\)
2
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
0,2 0,2 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\\
m_{MgSO_4}=120.0,2=24\left(g\right)\\
V_{\text{dd}H_2SO_4}=\dfrac{0,2}{1}=0,2M\)

a. Trọng lượng của vật là:
P=10.m= 10.15=150N
Trọng lực có phương thẳng đứng, chiều từ trên xuống dưới.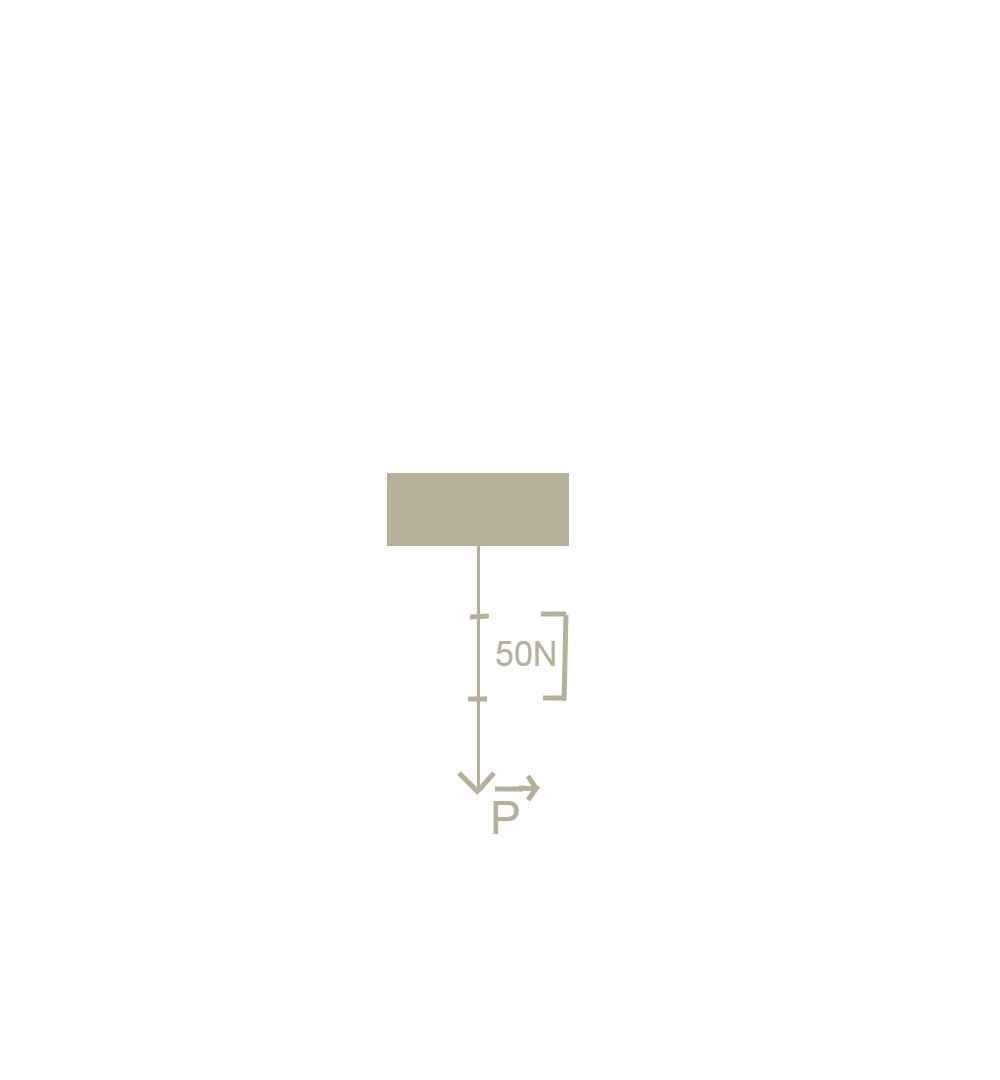 b.
b.  c.Trọng lượng của vật là:
c.Trọng lượng của vật là:
P= 10.m= 10.6=60N
Trọng lượng có phương thẳng, đứng chiều từ trên xuống dưới.
Vì vật đang đứng yên, nên chứng tỏ đã có 2 lực cân bằng tác dụng vào vật. Đó là trọng lực và lực nâng (P = Q)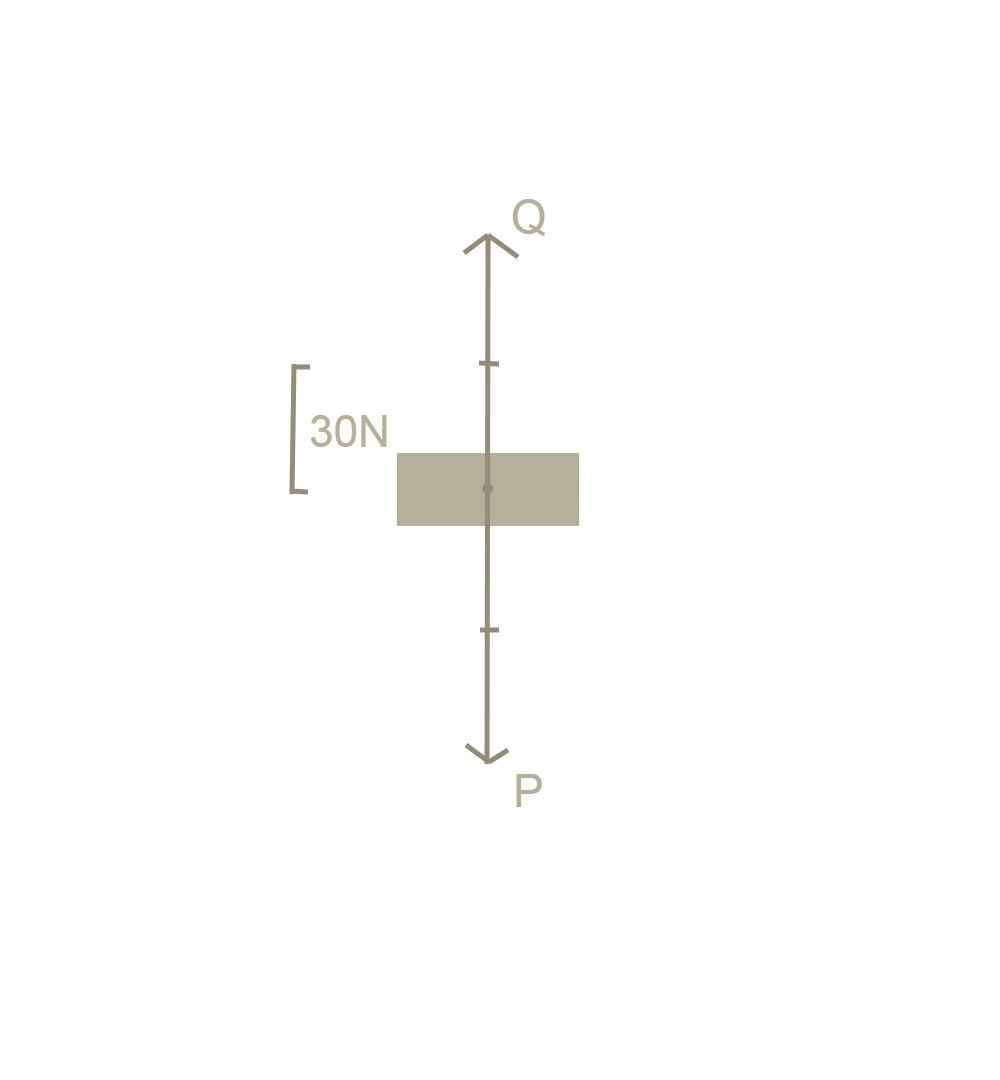










\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(n_{HCl}=\dfrac{300\cdot7.3}{100\cdot36.5}=0.6\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2.......0.4........0.2.......0.2\)
\(\Rightarrow HCldư\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{HCl\left(pư\right)}=0.4\cdot36.5=14.6\left(g\right)\)
\(m_{HCl\left(dư\right)}=\left(0.6-0.4\right)\cdot36.5=7.3\left(g\right)\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=13+300-0.2\cdot2=312.6\left(g\right)\)
\(C\%_{HCl\left(dư\right)}=\dfrac{7.3}{312.6}\cdot100\%=2.3\%\)
\(C\%_{ZnCl_2}=\dfrac{27.2}{312.6}\cdot100\%=8.7\%\)