
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



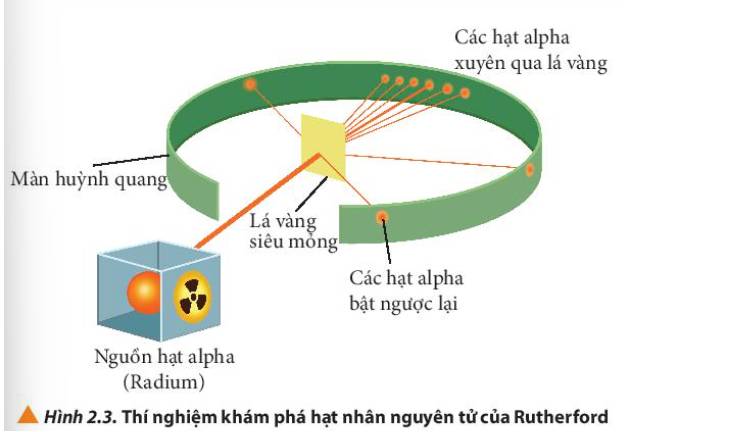
- Quan sát Hình 2.3 thấy được: hầu hết các hạt α đi thẳng, có vài hạt bị bắn theo đường gấp khúc
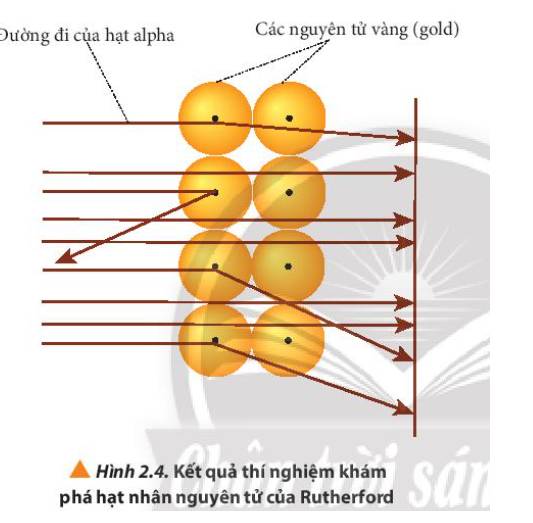
- Quan sát Hình 2.4 giải thích: các hạt α bị bắn theo đường gấp khúc là do va vào hạt nhân của nguyên tử vàng, các hạt không va vào hạt nhân thì đi thẳng
- Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.

Phản ứng (1) và (2) có sự tham gia của chất khí
=> Áp suất ảnh hưởng đến tốc độ phản ứng (1) và (2).

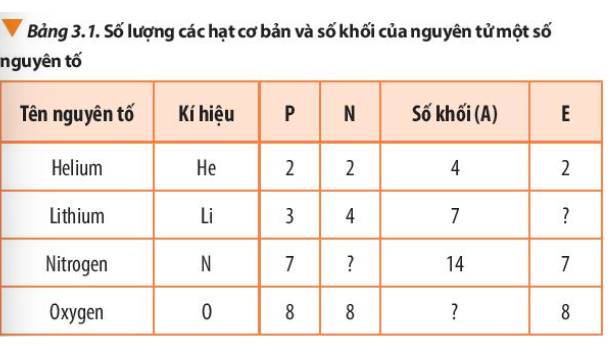
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
Helium | He | 2 | 2 | 4 | 2 |
Lithium | Li | 3 | 4 | 7 | 3 |
Nitrogen | N | 7 | 7 | 14 | 7 |
Oxygen | O | 8 | 8 | 16 | 8 |

- Giữa các phân tử nước hình thành lực liên kết hydrogen
=> Liên kết hydrogen giữa các phân tử nước trên bề mặt nước và giữa các phân tử nước trên bề mặt và lớp nước bên dưới tạo ra sức căng bề mặt cho nước
- Chân của con nhện nước gồm các chất kị nước (không phân cực), phân tử các chất nảy đẩy nước khiến cho chân của nhện nước không bị nước bao bọc và tụt xuống dưới nước. Vì vậy chúng có thể di chuyển trên bề mặt nước mà không làm vỡ bề mặt nước
Liên kết hydrogen giữa các phân tử nước trên bề mặt nước và giữa các phân tử nước trên bề mặt với lớp nước bên dưới tạo ra sức căng bề mặt cho nước. Chân của con nhện nước gồm các chất kị nước, phân tử các chất này đẩy nước khiến cho chân của nhện nước không bị nước bao bọc và tụt xuống dưới nước. Vì vậy chúng có thể di chuyển trên bề mặt nước mà không làm vỡ bề mặt nước.

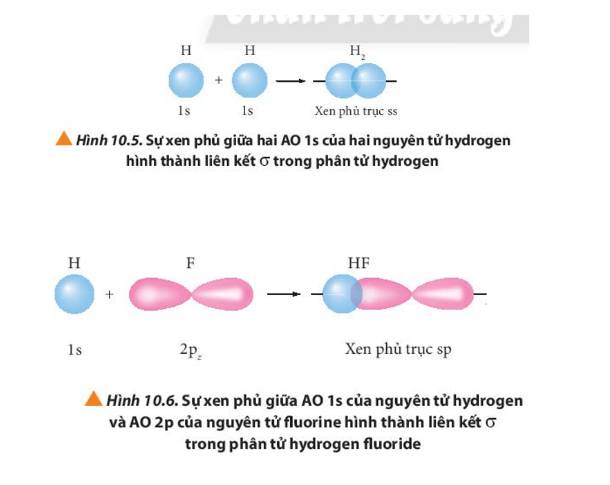
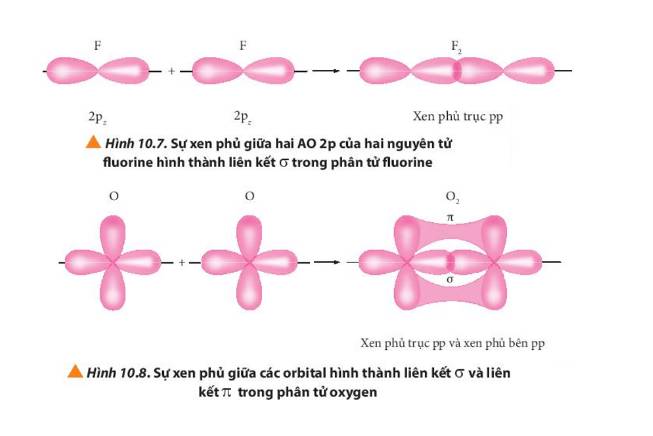
- Liên kết σ trong mỗi phân tử được tạo thành bởi sự xen phủ trục
- Liên kết п trong mỗi phân tử được tạo thành bởi sự xen phủ bên

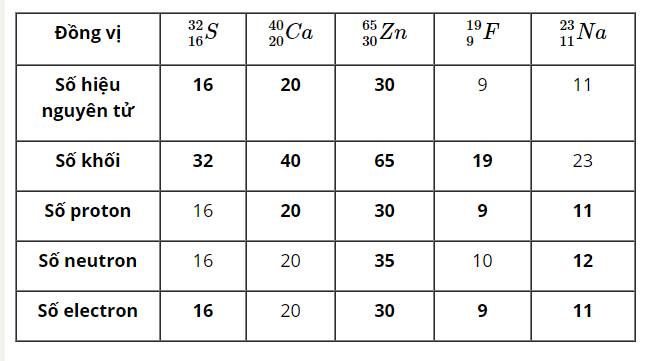
Hàng 1: \(^{32}_{16}S,^{40}_{20}Ca,^{65}_{30}Zn,^{19}_9F,^{23}_{11}Na\)
Hàng 2: 16, 20, 30, 8, 11
Hàng 3: 32, 40, 65, 18, 23
Hàng 4: 16, 20, 30, 9, 11
Hàng 5: 16, 20, 35, 10, 12
Hàng 6: 16,20,30,9,11



 ai giải cho e bài 10 vs ạaa :<
ai giải cho e bài 10 vs ạaa :< 

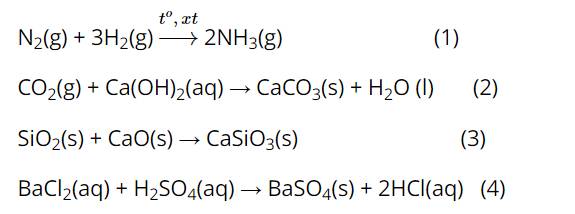


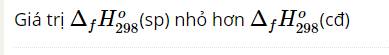
a) 79,9862
b) 6,925
c) 28,1087