Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ 3Fe+8HNO_3\rightarrow3Fe\left(NO_3\right)_2+2NO+4H_2O\\ n_{Fe\left(NO_3\right)_2}=n_{Fe}=0,1mol\\ m_{Fe\left(NO_3\right)_2}=0,1.180=18g\\ n_{NO}=0,1\cdot\dfrac{2}{3}=\dfrac{1}{15}mol\\ V_{NO}=\dfrac{1}{15}\cdot22,4=\dfrac{112}{75}\approx1,49l\)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
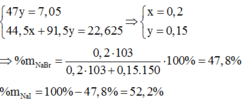

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

\(n_K=\dfrac{5,85}{39}=0,15\left(mol\right)\)
PTHH: 2K + 2H2O --> 2KOH + H2
_____0,15------------->0,15-->0,075
=> VH2 = 0,075.22,4 =1,68(l)
mdd = 5,85 + 100 - 0,075.2 = 105,7(g)
=> \(C\%=\dfrac{0,15.56}{105,7}.100\%=7,95\%\)

Câu 1:
PTHH: \(Na+\dfrac{1}{2}Cl_2\xrightarrow[]{t^o}NaCl\)
Ta có: \(n_{NaCl}=2n_{Cl_2}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\)
Câu 2:
Ta có: \(n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\) \(\Rightarrow m_{H_2}=0,04\cdot2=0,08\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,08\left(mol\right)\) \(\Rightarrow m_{HCl}=0,08\cdot36,5=2,92\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=4,29\left(g\right)\)




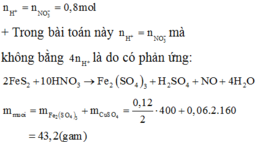


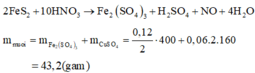
\(n_{N_2}=\dfrac{0,224}{22,4}=0,01mol\\ 5Mg+12HNO_3\rightarrow5Mg\left(NO_3\right)_2+N_2+6H_2O\\ n_{Mg\left(NO_3\right)_2}=n_{Mg}=0,01.5=0,05mol\\ m_{Mg\left(NO_3\right)_2}=0,05.148=7,4g\\ n_{HNO_3}=0,01.12=0,12mol\\ m_{ddHNO_3}=\dfrac{0,12.63}{20\%}\cdot100\%=37,8g\\ m_{ddMg\left(NO_3\right)_2}=0,05.24+37,8-0,01.28=38g\\ C_{\%Mg\left(NO_3\right)_2}=\dfrac{7,4}{38}\cdot100\%=19,47\%\)