Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{N_2}=\dfrac{0,224}{22,4}=0,01mol\\ 5Mg+12HNO_3\rightarrow5Mg\left(NO_3\right)_2+N_2+6H_2O\\ n_{Mg\left(NO_3\right)_2}=n_{Mg}=0,01.5=0,05mol\\ m_{Mg\left(NO_3\right)_2}=0,05.148=7,4g\\ n_{HNO_3}=0,01.12=0,12mol\\ m_{ddHNO_3}=\dfrac{0,12.63}{20\%}\cdot100\%=37,8g\\ m_{ddMg\left(NO_3\right)_2}=0,05.24+37,8-0,01.28=38g\\ C_{\%Mg\left(NO_3\right)_2}=\dfrac{7,4}{38}\cdot100\%=19,47\%\)

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

Coi hh X gồm Fe, Cu và O
Đặt \(n_{Fe\left(Fe_xO_y\right)}=a;n_{Cu}=b;n_{O\left(Fe_xO_y\right)}=c\) ( mol )
\(\Rightarrow m_{hh}=56a+64b+16c=14,64\left(g\right)\) (1)
\(m_{muối}=m_{Fe\left(NO_3\right)_3}+m_{Cu\left(NO_3\right)_2}=242a+188b=47,58\left(g\right)\) (2)
Bảo toàn e: \(3n_{Fe}+2n_{Cu}=2n_O+3n_{NO}=3a+2b=2c+3.0,09\) (3)
\(\left(1\right);\left(2\right);\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,15\\b=0,06\\c=0,15\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,06.64}{14,64}.100=26,22\%\)
\(\dfrac{x}{y}=\dfrac{0,15}{0,15}=\dfrac{1}{1}\Rightarrow CTHH:FeO\)

Đáp án A
Gọi M là kim loại chung cho Al, Fe và Zn với hóa trị n.
Sơ đồ phản ứng:
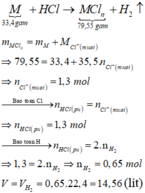

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
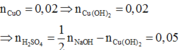
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
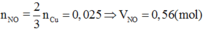

Đáp án B
mNaOH = v.d.C% = 31,25.1,12.16% = 5,6 (gam)
Þ nNaOH = 0,14
Các phản ứng xảy ra theo thứ tự:
2NaOH + H2SO4 g Na2SO4 + 2H2O
Cu(NO3)2 + 2NaOH g Cu(OH)2¯ + 2NaNO3
Cu(OH)2 g CuO + H2O
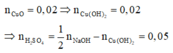
Do đó trong 50ml dung dịch B chứa 0,05 mol H2SO4 và 0,02 mol Cu(NO3)2 .
Khi cho 50ml dung dịch B tác dụng với 0,0375 mol Cu thì:
3Cu+4H2SO4+Cu(NO3)2g4CuSO4+2NO+4H2O
Do đó
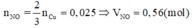

a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe^0 \to Fe^{+3} + 3e$
$N^{+5} + 3e \to N^{+2}$
Bảo toàn electron : $3n_{Fe} = 3n_{NO}$
$\Rightarrow n_{NO} = 0,2(mol)$
$\Rightarrow V = 0,2.22,4 = 4,48(lít)$
b) $n_{Fe(NO_3)_3} = n_{Fe} = 0,2(mol)$
$\Rightarrow m = 0,2.242 = 48,4(gam)$

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g
\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ 3Fe+8HNO_3\rightarrow3Fe\left(NO_3\right)_2+2NO+4H_2O\\ n_{Fe\left(NO_3\right)_2}=n_{Fe}=0,1mol\\ m_{Fe\left(NO_3\right)_2}=0,1.180=18g\\ n_{NO}=0,1\cdot\dfrac{2}{3}=\dfrac{1}{15}mol\\ V_{NO}=\dfrac{1}{15}\cdot22,4=\dfrac{112}{75}\approx1,49l\)