Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\Delta_rH^0_{298}=-542,83-167,16-\left(-795,0\right)=85,01\left(kJ\right)\)
\(\Delta_fH^0_{298}=-542,83-2.167,16-\left(-795,0\right)\) \(=-82,15\left(kJ\right)\)

Ta có bảng sau khi điền
|
Điều chế |
Dung dịch điện phân |
Sản phẩm ở cực dương |
Sản phẩm ở cực âm |
|
Khí oxi |
H2O pha thêm H2SO4 |
Khí oxi |
Khí hiđro |
|
Khí clo |
NaCl (có màng ngăn) |
Khí clo |
Khí hiđro |
Phương trình điện phân :
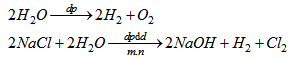

Biến thiên enthalpy chuẩn của phản ứng trên là:
\(\Delta_rH^0_{298}=\) \(2.\Delta_fH^0_{298}\left(CO_2\right)+3.\Delta_fH^0_{298}\left(H_2O\right)-\Delta_fH^0_{298}\left(C_2H_6\right)-\Delta_fH^0_{298}\left(O_2\right)\)
\(=2.\left(-393,50\right)+3\left(-285,84\right)-\left(-84,70\right)=-1559,82\left(kJ\right)\)
ΔfH298=ΣΔ fH298(sp) - ΣΔfH298 (cd) = 2.(-393,5) + 3.(-285,84) - (-84,7) = -1559,82 kJ.

Dễ thấy :
Với X , từ I2 lên I3 tăng đột ngột , vậy ion \(X^{2+}\) có cấu hình của một khí hiếm nên :
\(X:\left[Ar\right]4s^2\left(Ca\right)\)
Với Y , từ I4 lên I5 tăng đột ngột , vậy ion \(I^{4+}\)có cấu hình của một khí hiếm nên :
\(Y:\left[He\right]2s^22p^2\left(C\right)\)
Vậy ...
P/s : bài này mk có lm rồi :D

| Tên hoá chất | Công thức hoá học | Công thức cấu tạo | Loại liên kết |
| Hiđro | \(H_2\) | \(H-H\) | Cộng hoá trị không cực |
| Oxi | \(O_2\) | \(O=O\) | Cộng hoá trị không cực |
| Ozon | \(O_3\) | \(O=O\rightarrow O\) | Cộng hoá trị không cực |
| Nitơ | \(N_2\) | \(N\equiv N\) | Cộng hoá trị không cực |
| Cacbon monoxit | \(CO\) | C O | Cộng hoá trị có cực |
| Cacbon đioxit | \(CO_2\) | \(O=C=O\) | Cộng hoá trị không cực |
| Nước | \(H_2O\) | \(H-O-H\) | Cộng hoá trị có cực |
| Liti florua | \(LiF\) | \(Li^+\cdot\cdot\cdot\cdot\cdot F^-\) | Liên kết ion |
| Flo | \(F_2\) | \(F-F\) | Cộng hoá trị không cực |
| Clo monoflorua | \(ClF\) | \(Cl-F\) | Cộng hoá trị có cực |
| Clo | \(Cl_2\) | \(Cl-Cl\) | Cộng hoá trị không cực |
| Lưu huỳnh đioxit | \(SO_2\) | \(O=S\rightarrow O\) | Cộng hoá trị có cực |
| Hiđro peroxit | \(H_2O_2\) | \(H-O-O-H\) | Cộng hoá trị có cực |
| Lưu huỳnh monoxit | \(SO\) | \(S=O\) | Cộng hoá trị có cực |

1. Phương trình hóa học của các phản ứng xảy ra trong thí nghiệm:
Na2O + H2O → 2NaOH
MgO + H2O → Mg(OH)2
P2O5 + 3H2O → 2H3PO4
2.
Na2O tan tốt trong nước, MgO tan một phần trong nước và làm quỳ chuyển màu xanh
=> Na2O có tính base mạnh hơn MgO, tính base của NaOH mạnh hơn Mg(OH)2
P2O5 tan tốt trong nước, làm quỳ chuyển màu đỏ => P2O5 có tính acid và H3PO4 là một acid.

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)
Đáp án D
Phương trình phản ứng: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S ↓ + SO 2 ↑ + H 2 O
Nồng độ chất tham gia phản ứng càng cao (nồng độ các chất trong dung dịch hỗn hợp khi trộn các chất với nhau), tốc độ phản ứng càng nhanh, thời gian kết tủa càng ngắn.
Ở đây, nồng độ dung dịch H2SO4 được giữ cố định (1 giọt), do đó trong dung dịch hỗn hợp thu được nồng độ H2SO4 không đổi, dẫn đến tốc độ phản ứng chỉ còn phụ thuộc vào nồng độ Na2S2O3.
Thứ tự tăng nồng độ Na2S2O3 trong các thí nghiệm sau: thí nghiệm 2 (12 giọt Na2S2O3 + 0 giọt H2O) > thí nghiệm 3 (8 giọt Na2S2O3 + 4 giọt H2O) > thí nghiệm 1 (4 giọt Na2S2O3 + 8 giọt H2O).
Vậy thời gian xuất hiện kết tủa theo thứ tự là t 1 > t 3 > t 2 .