Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)

Đáp án C.
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol); nS = 0,15 (mol)
nH2S = nMgS = nS = 0,15 mol;
nH2= nMg (dư) = 0,2 – 0,15 = 0,05 (mol)
=> MY = (0,15.34+0,05.2)/(0,15+0,05)=26

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Ta có pthh:
\(Fe+S\underrightarrow{t^o}FeS\left(1\right)\)
x1 x1 x1 (mol)
Sau khi nung trong hỗn hợp A có :
\(\left(x-x_1\right)molS\)
\(\left(2x-x_1\right)molFe\)
và x1 mol FeS
- hòa tan A trong axit HCl dư :
\(Fe+2HCl\rightarrow FeCL_2+H_2\uparrow\left(2\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\left(3\right)\)
Còn lại 0,4 g chất rắn B là lưu huỳnh dư
\(nS=x-x_1=\dfrac{0,4}{32}=0,0125\left(mol\right)\left(I\right)\)
Dung dịch C gồm HCl dư và FeCl2 với số mol là 2x .
Khí D gồm H2 và H2S .
Sục khí D từ từ vào dung dịch CuCl2 dư , chỉ có H2S phản ứng.
\(CuCl_2+H_2S\rightarrow CuS\downarrow+2HCl\left(4\right)\)
Kết tủa đen tạo thành là CuS
theo (1) (2) , (4) :
\(nCuS=x_1=\dfrac{4,8}{96}=0,05\left(mol\right)\left(II\right)\)
Kết hợp (I) ; và (II) ta có : x - x1= 0,0125
x = 0,0125 + 0,05 = 0,0625
Hiệu suất pứ tạo thành hh A:
Theo S: \(h\%=\dfrac{0,05}{0,0625}.100\%=80\%\)

Đáp án B
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,2 (mol), nS = 0,15 9mol)
nH2S = nMgS = nS = 0,15 mol;
nH2 = nMg (dư) = 0,2 – 0,15 =0,05 (mol)
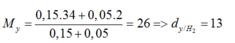
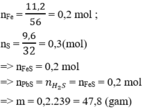

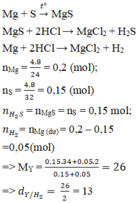
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
PTHH: Fe + S --to--> FeS
LTL: \(0,2>0,1\rightarrow\) Fe dư
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\\ \rightarrow n_{Fe\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2
0,1 0,2
Fe + 2HCl ---> FeCl2 + H2
0,1 0,2
\(\rightarrow V_{ddHCl}=\dfrac{0,2+0,2}{0,5}=0,8\left(l\right)\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_S=\dfrac{3,2}{32}=0,1mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
0,2 < 0,1 ( mol )
0,1 0,1 ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
0,1 0,2 ( mol )
\(V_{HCl}=\dfrac{0,2}{0,5}=0,4l\)